目次
はじめに
ここでは、東京書籍 改訂 科学と人間生活をベースに講義を進めていきます。
資料のダウンロードはこちらからお願いします。
授業資料にある問題の解答はこちらを確認してください。
※画面をタップすると答えが順番に表示されます。
第1章 材料とその再利用 ①金属 金属に特有の性質・金属の構造 教科書P60
今回は教科書P60の範囲を学習します。予め教科書の内容に目を通しておくと、効率よく学習が進められます。
☝本時の目標
1.代表的な元素記号(1H-20Caと教科書に出てくる物質)を覚えよう。
2.原子の構造を理解しよう。(原子核・陽子・中性子・電子・電子殻)
3.金属の性質を覚えよう。(展性・延性・金属光沢・自由電子)
2.原子の構造を理解しよう。(原子核・陽子・中性子・電子・電子殻)
3.金属の性質を覚えよう。(展性・延性・金属光沢・自由電子)
1.代表的な元素記号と教科書に出てくる物質の確認

長兄:ラオウ
それでは、講義を始めよう。今日は、教科書60ページ、「金属に特有の性質」について解説しよう。

三男:ジャギ
金属に特有の性質か・・・。

今回も本題に入る前に、重要な元素記号と、60ページ出てくる物質を確認しよう。
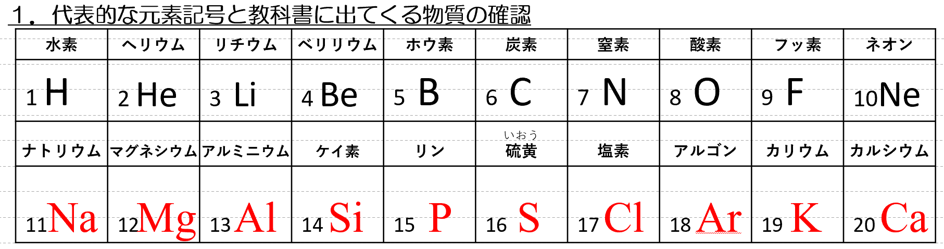

元素記号が20個に増えているじゃねぇか?兄者!!

弱音ばかり吐いていたら、末弟のケンシロウに追い抜かされてしまうぞ!
一度に全てを覚えるのは大変だから、少しずつ覚えていけば良い。
一度に全てを覚えるのは大変だから、少しずつ覚えていけば良い。

兄よりすぐれた弟なぞ、存在しねぇ!
よぉ~し、覚えてやるぜ。
よぉ~し、覚えてやるぜ。

うむ。ところでジャギよ。教科書に出てくる塩酸って、どんな物質か知っているか?

あぁ、知っているとも。強い酸性を示す物質で、塩化水素のことだろ!?

よく理解しているな!と褒めてやりたいところだが、1つだけ誤りがある。


塩酸は、「塩化水素のこと」だけではなくて、「塩化水素と水の混合物」のことだから注意するのだ。

へぇ~。そうなのか・・・。

同じく水酸化ナトリウム水溶液は、NaOHとH2Oの混合物だ。硝酸(しょうさん)は、塩酸と同じく、強力な酸性物質で、元素記号を使ってHNO3と表現する。

硝酸は、水素原子(H)が1つ、窒素原子(N)が1つ、酸素原子(O)が3つくっついて出来ているのか。

そうだな。元素記号で物質を表現したものを化学式という。化学式をみて、どんな原子が何個含まれているのか、理解することも大切だ。金属の酸や塩基に対する反応は、次の動画にまとめたから興味のある人は確認してくれたまえ!
2.原子の構造

よぉ~し。では兄者、そろそろ本題に入ってくれよ。

そうしたいところだが、金属の性質を語る前に、原子の構造について説明せねばなるまい。

なんだってぇ!

まぁ、落ち着け弟よ。ここでは必要最小限の説明だけにして、本題に入るつもりだ。より詳しい解説については、下の動画を見ておけば良いだろう。

わかったぜ。兄者。では、先に進んでくれ。

前回の講義で、「物質を構成している基本的な粒子」として原子の話をしたことを覚えているな。原子は約120種類あることがわかっているのだが、この全ての原子は、さらに細かな3種類の粒子から出来ていることがわかっている。


なにぃ~っ。これ以上分割できないと思っていた原子が、さらに細かな粒子に分かれるだって!?

そうなのだ。全ての原子は、④陽子、⑤中性子、⑥電子という3種類の粒子から構成されている。例えば、アルミニウムだと次の図のようになる。


おい、兄者。これは何だ? 中心にある「13+」と書かれた○は?

これはなぁ、原子の中心にある「⑦原子核」という場所を示している。ここに、陽子と中性子が存在するのだ。

原子核かぁ・・・。それで、「13+」ってのは何だい?

13というのは、陽子が存在する数を示している。陽子という粒子は、プラスの電気を身にまとっている。だから、原子核には陽子が13個あることに加えて、プラスの電気が存在することを表現するために「13+」と書かれているのだ。ちなみに、それぞれの原子に与えられる原子番号は、この陽子の数に由来している。

じゃあ、中性子は中性だけに、プラスマイナス0と考えると・・・。

その通りだ。中性子は電気を持たない中性の粒子だから中性子という。

それから外側の輪っかみたいなのは??

これは、「⑧電子殻」といってな、ここに電子が存在しているのだ。

殻(から)と書いて、「かく」と読むのかぁ・・・。何か、地球みたいだなぁ。地球の中心のことを「核」。地球の表面を「地殻(ちかく)」って言うからなぁ。

うむ。そのイメージでよい。漢字の読み方にも注意しておきたいところだ。電子は、マイナスの電気を持っているから、教科書では、○の中に「-」を書いて表現している。ここでは、●で表現したものが電子だ。

それで、●も13個あるのかぁ。

そうだ。そして、電子の配列にはルールがあるのだが、それを説明すると長くなるから、ここでは触れないことにする。興味がある人は、こちらの動画を見てくれたまえ。

わかったぜぇ、兄者。どんどん、先に進んでくれ。

アルミニウム原子の構造は、先ほど示した通りだが、13個ある電子の内、一番外側の円周上にある3つの電子のことを自由電子という。

自由な電子か・・・。

そうだ。自由に動き回るから自由電子だ。この自由電子のはたらきによって、金属は特有の性質を示すことがわかっているのだ。

そうかぁ。内側にある10個の電子は、何か動きにくそうで窮屈な感じがするからなぁ。

ただし、自由電子という名称は、金属元素に特有のものであることに注意するのだ。より詳しいことが知りたければ、次の動画を参考にするがよい。
3.金属に特有の性質

いよいよ本題だなぁ。兄者。

うむ。先ほどの説明の通り、金属には自由電子が存在することによって、次のような性質を示すことがわかっている。


自由電子は、プラスの電気を持つ原子核と引き合いながら、金属の内部を自由に動き回るから、金属原子どうしを結び付ける接着剤のような役割を果たしている。

接着剤かぁ・・・。

だから、金属は叩くなどの強い衝撃を加えても、延びたり、薄く広がったりして、簡単に砕け散ることがないのだ。

この性質を「⑨延性」とか、「⑩展性」って言うんだな。

そうだ。金属は、外側から強い力が加わっても、自由電子が柔軟に対応するから、簡単に折れたり砕けたりすることがない。金属を実際に叩いてみた様子は、こちらの動画を見るがよい。

ふ~ん。自由に動けるのって、何かと便利だね。あっ、そっか。自由電子は、金属の中を自由に動き回れるから、金属は電気をよく通すんだなぁ。

その通りだ。物質の内部を自由に動くから、金属は、電気や熱をよく通す。そして、この自由電子は、光を跳ね返すために、金属には独特の輝き(金属光沢)がある。

自由電子のはたらきって重要だね。

そうだな。自由電子だけに限らず、電子は、化学反応に関わる重要なはたらきをすることがわかっている。科学の世界は奥が深い。さて、今日の講義はここまでとしよう。この先の学習課題は、自分たちのペースに合わせて進めば良いだろう。それでは、皆の健闘を祈る!!
【発展学習】
もう少し詳しく学習したい人は、こちらの動画に進んでください。
問題演習(解答・解説)
教科書や講義の内容を参考に、資料の学習課題に取り組もう。

実際の反応は、こちらの動画を確認しよう。

教科書P60、5行目より
「銅は、塩酸に溶けないが、硝酸などには溶ける。」とある。

(1)は教科書P59あるいは、No.1を参照。

原子番号11はナトリウムである。ナトリウムの反応性については、次の動画を確認しよう。

教科書P60の内容より、金属の性質を3つ抜き出せばよい。
お疲れ様でした。
今回の学習は、ここまでです。
◎異なる単元の学習は、こちらのガイドを活用ください。