それでは、今日の講義を始めよう。
今回は共有結合について確認していこう。
これまでイオンについて学習してきたが、イオンになる原子は、自分の近くにある貴ガス原子と同じ電子配置をとるんだったなぁ。単独で不安定な原子は、貴ガス原子の電子配置に憧れ、安定性を求めて、時には電子を放出したり、時には電子を受け取ったりする。それが今まで学習してきた陽イオンと陰イオンからなるイオン結合だ。
今から説明する共有結合も実は、貴ガス原子の電子配置がポイントになってくる。
■ポイント1:共有結合
さて、それではまず水素原子による共有結合を見ていこう。
こちらに水素原子がある。単独では不安定な水素原子だ。
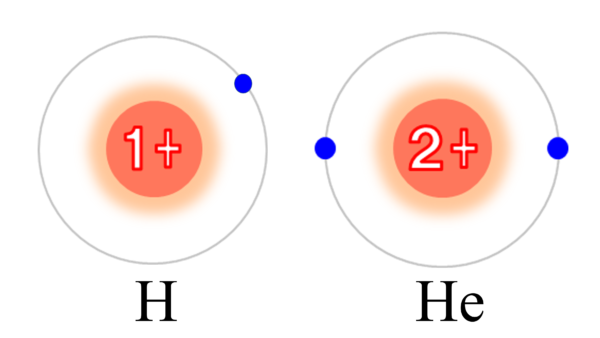
「後1つだけ電子があれば、お隣のヘリウム原子と同じ安定で裕福な電子配置となれるのにぃ・・・」、
と非常にひもじい思いをしているところに、もう一人の貧しい水素原子が現れた。
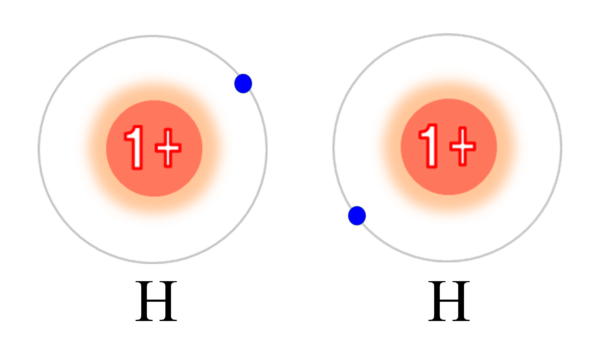
さぁ、ここでお互いの電子の奪い合いか??と思いきや、
この水素原子は略奪より平和的な解決方法を選んだ。
お互いが身を寄せ合い、支え合って生活すれば、安定した生活が送れるではないか。
そこで2人の水素原子は、互いの電子を共有することにした。
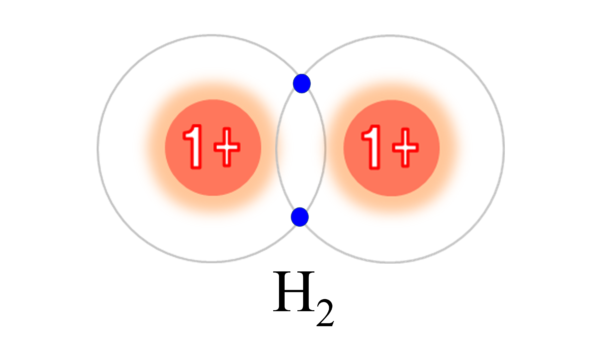
この両者の結びつきのことを共有結合という。
もう1つ見てみよう。
ここに酸素原子がある。酸素原子の電子配置図は書けるかな??
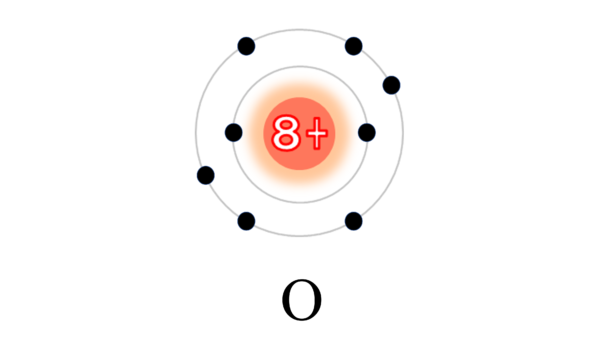
この酸素原子も単独では不安定な原子だ。
「後2つだけ電子があれば、近くのネオン原子と同じ安定な電子配置になるのにぃ・・・」、
と絶望していた時に、2人の救世主があらわれた。そう、さっきの水素原子だ。
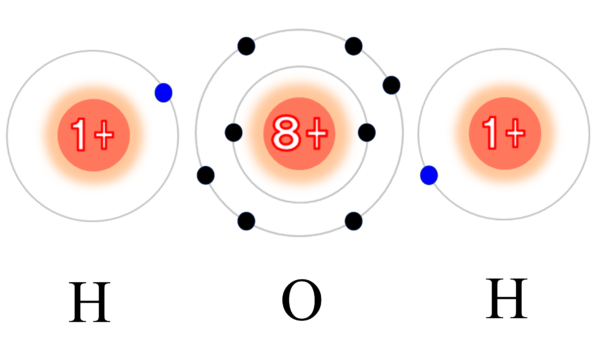
さぁ、それでは早速合体だ。これで、最初は不安定だった酸素原子と水素原子がお互いの電子を共有し、共有結合を作ることによって安定化した。これが皆も知っているH2O。水だ。
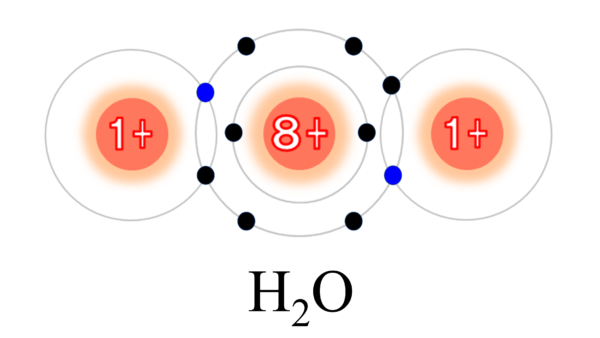
さて、ここで共有結合についてまとめておこう。
そして、
イオン結合のようにプラスとマイナスがクーロン力で引き合うのではなく、価電子を共有するところが共有結合のポイントだ。
■ポイント2:電子式
次に進もう。
今、共有結合の原理について確認したが、この図を毎回表現するのは手間がかかってしまう。




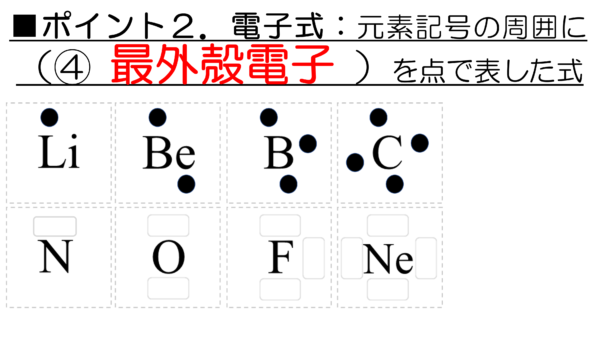

リチウムは上に1つ、ベリリウムは上下に1つずつ、ホウ素は上下に1つずつと右側に1つ、炭素は上下左右に1つずつだ。



今まで何を学習してきたんだ貴様は!?仕方あるまい。それではヒントを与えよう。
これは化学反応に関わるものを表現している。


しかし、ここでは最外殻電子と言った方が正しいな。
化学反応に関わる電子が価電子だった。共有結合は、この価電子が関わる結合だから、原子核から電子まで全てを書き出すのではなく、元素記号の周囲に最外殻電子だけを書き出してみる。これを利用して共有結合を表現していこうという訳だ。
このように、
さて、それでは下段の4つの原子にも最外殻電子をつけ足してみようか。
電子式の書き方には順番があって、上下左右に対称になるように最外殻電子を書き足していく。原子番号7番の窒素原子は、最外殻電子が5つあるから、最初の4つはこのように書く。そして、最後の5つ目は、ペアを作るように同じ場所に書き足していくのだ。
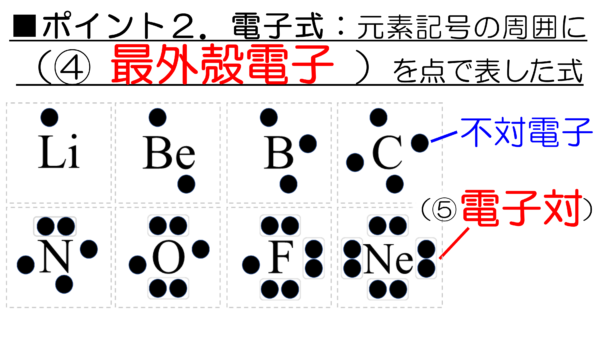
残りの酸素、フッ素、ネオンについても同じように順番に書き足していく。
すると、こうなる。
この表現方法しっかりと覚えてもらいたい。
そして、もう少し確認しておきたいことがある。
このペアになっている電子。これには、名前が与えられている。
電子対というのだ。電子の対、対とはペアを意味する言葉だ。
それに対して、ペアになっていない電子のことを不対電子という。
ペアでない電子ということだ。
□電子式の書き方
さぁ、それでは電子式の書き方を確認しよう。
こちらはさっき説明した水素と酸素、そして、それらが共有結合した水分子だ。
さぁ、これを電子式で表現してみよう。すると、こうなる。まずは酸素と水素からだ。
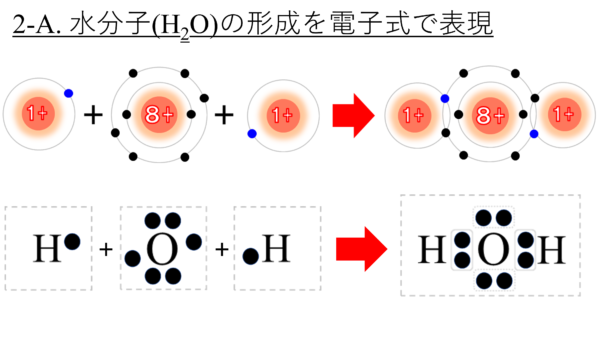
皆も一緒にテキストに書き込んでみたまえ。どうだね。シンプルですっきりしているだろう。
価電子1の水素、価電子6の酸素。必要な情報はこれだけでいいのだ。
もはや、原子核やK殻のような輪っかを描く必要はない。
そして、これらが結合した水分子はこうだ。
ほーら。シンプルではないか。すごいだろ。これがH2Oだ。
それから、酸素原子には4つの電子対があるだろ。その内、水素酸素の電子を共有したペア。これを共有電子対という。
さぁ、それでは電子式を使って、炭素と酸素からなる物質、二酸化炭素を表現してみようではないか。
電子配置図を描いて考えることもできるが、それはやめておこう。
電子式を使おう。それがこちらだ。
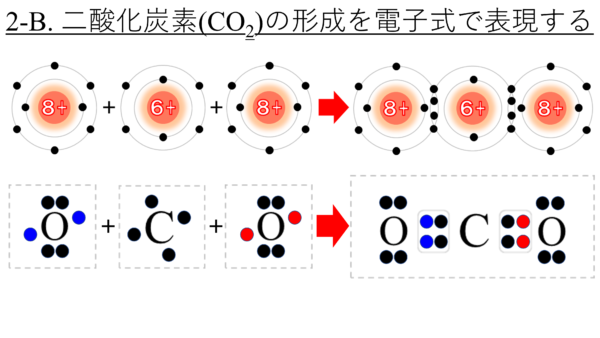
最外殻電子しか書かないから、電子式のおかげで価電子の様子が良くわかる。
さぁ、今、炭素原子からは手が4本、酸素原子からは手が2本出ている。
少し強引だが、この3つの原子がそれぞれ手をつなぐと次のようになる。
これが二酸化炭素だ。
さらに行こう。
最後は窒素原子だ。電子式で書くとこうだ。この3つの不対電子が結合を作る。
するとこうだ。
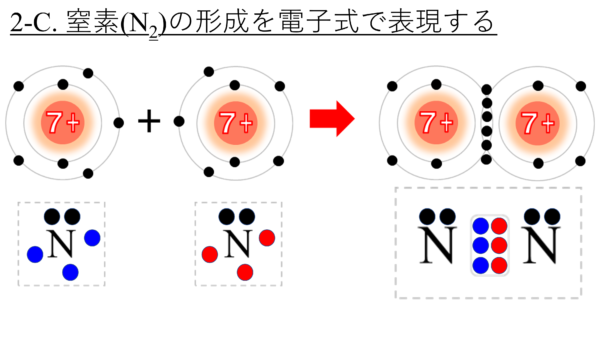
ペアとなる共有電子対が1つ、2つ、3つある。
それぞれの原子の電子配置がわかっていたら、共有結合は電子式で表現した方がわかりやすい。
今回学習した内容、しっかりと押さえてもらいたい。
さて、それでは今日の講義はここまでとしておこう。皆の健闘を祈る。
◎異なる単元の学習は、こちらのガイドを活用ください。