それでは、今日の講義を始めよう。
動画による解説はこちら(↓↓↓)を参照ください。
■ポイント1:単原子イオンと多原子イオン
まずは単原子イオンと多原子イオンからだ。
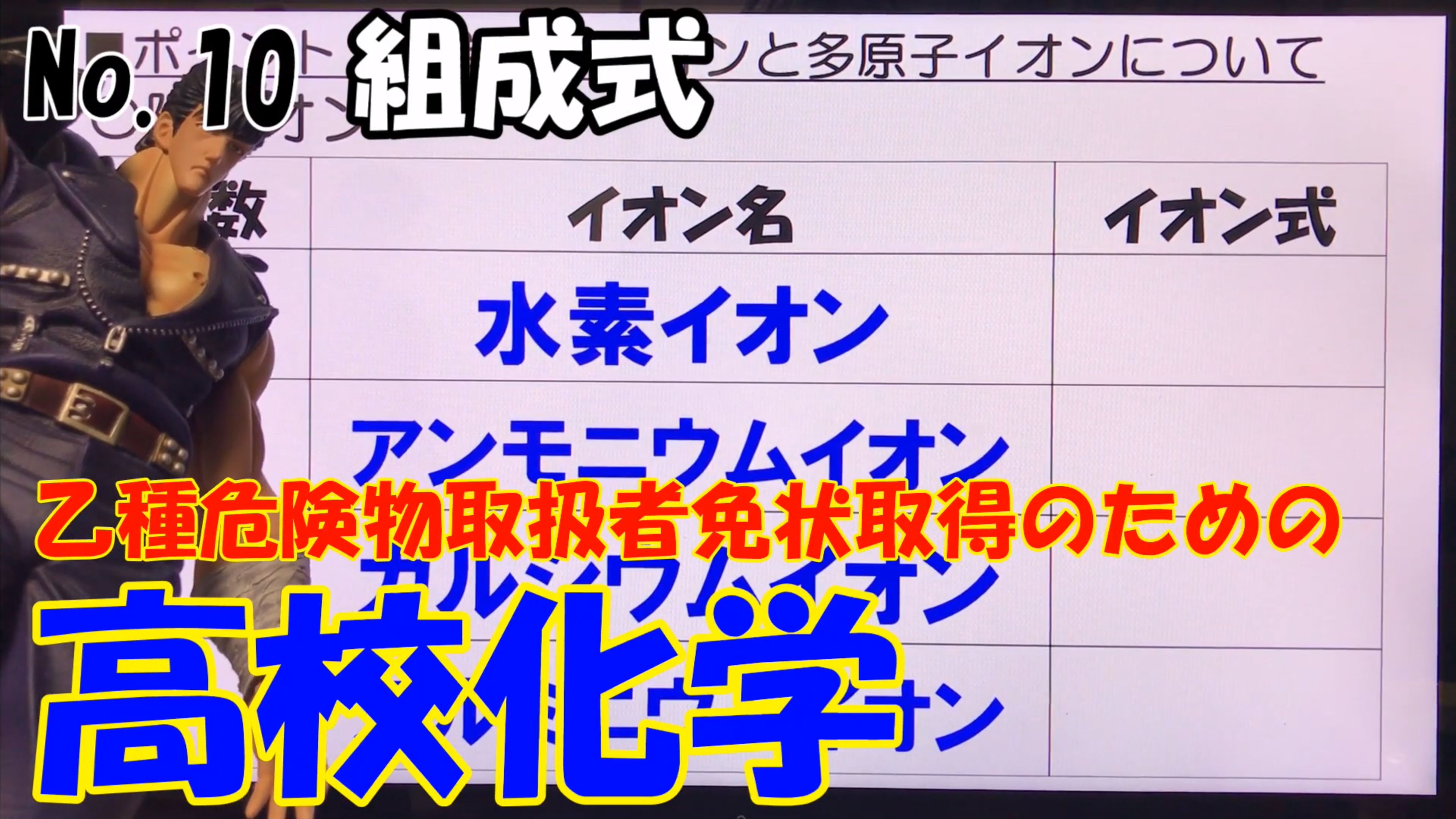
それでは最初に、代表的な陽イオンの価数とイオン式から見ていこう。

水素のイオンは、このようにH+と書いて表現する。
次のアンモニウムイオン。アンモニアがイオンになったものだ。
これはNH4+と書く。
どんどんいこう。カルシウムイオンはCa2+と書き、さらにアルミニウムイオンはAl3+と書く。
さぁ、これで表にあるイオン式は全て書いた。しかし、左側の価数がまだ埋まっていないから、こちらを見ていこう。イオンの価数は、陽イオンであれば、電子を失った個数書けばいいわけだ。
ということで、このようになる。水素イオンとアンモニウムイオンは1価、カルシウムイオンは2価、アルミニウムイオンは3価と書く。
次に、代表的な陰イオンの価数とイオン式を見ていこう。

まずは、塩化物イオンだ。これは今までに何度か出てきたなぁ。Cl-と書く。次の水酸化物イオン。これはOH-と書く。さらに炭酸イオン。ここから難しくなってくる。CO32-と書く。Oの右下の3は酸素原子が3個あることを意味していることにも注意してほしい。少し複雑だ。さらに複雑なのがリン酸イオンだ。PO43-と書く。Oの右下に4と書いてあるから、リン酸イオンには4個の酸素原子が含まれていることも忘れないようにな。
大変だが、まずこれらのイオン式をすべて覚えてもらわないといけない。
さぁ、それでは価数の方を見ていこう。
陰イオンの価数は、電子をもらった個数書くことになる。
塩化物イオンは、以前確認した通り1個の電子を受けとって、水酸化物イオンも同じく価数は1。炭酸イオンは2-だから2個の電子を受けとり、リン酸イオンは3-だから3個の電子を受け取ったイオンであると理解できる。
さて、今、代表的な(陰イオンの)イオン式を確認してきた訳だが、塩化物イオンは1個の原子からなるイオン。それに対して、それ以外のイオンは2個以上の原子からなるイオンだ。これを次のように分類してまとめておこう。
2個以上の原子からなるイオンを多原子イオン。
(多原子イオンとは)多くの原子からなるイオンと言うことだな。これから先、さらに多くの単原子イオンや多原子イオンに遭遇することになると思うが、1個1個しっかりと覚えて行ってもらいたい。
■ポイント2:組成式:イオンからなる物質の表現方法
今からイオンからなる物質の表現方法について、伝えていくつもりだが、その前に、化学式の基本的な解読方法を確認しておこう。今、ここに3つの化学式が示してあり、それぞれの化学式にある2という数字を赤丸で囲んである。まずは、この数字の意味を確認していこう。
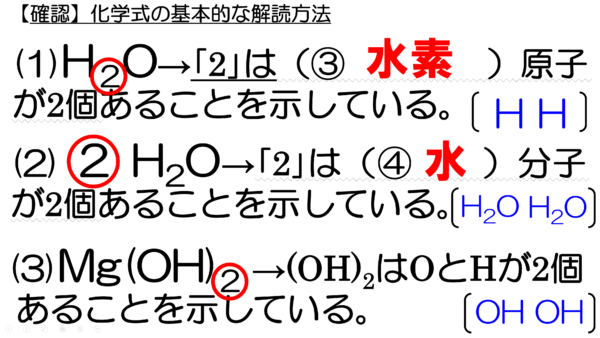
1つ目の2は、H2Oの水素原子の右下にある2だ。これは、水素原子が2個あることを示している。そして、2つ目の2は、2H2Oの左側にある2だ。これは、水分子が2個あることを示している。それから最後にMg(OH)2の2は、OとHが2つずつあることを示している。
それぞれの数字の意味を読み間違えることのないようによ~く注意してもらいたい。
それでは本題に移っていこう。
イオンからなる物質の表現方法だが、こいつはなかなか厄介な代物だ。
何が厄介なのかというと、さっき水分子H2Oと表現しただろ。水分子だったら、酸素原子の両側に2個の水素原子がくっついて存在しているから問題ない。
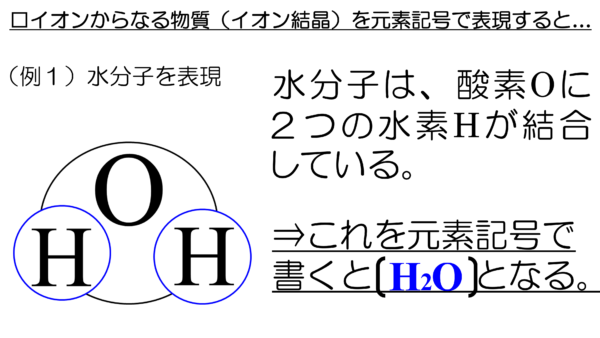
しかし、塩化ナトリウムの結晶を図にしてみるとこんな感じになっている。

ナトリウムイオンと塩化物イオンが上下左右そして前後に密接に結びついているではないか。これを元素記号を使って表現するとどうなる??
例えば、1gの塩化ナトリウムの塊(結晶)であれば、おおよそ、こんな感じ(上図参照)で書かなければならない。
どうだね。この化学式。こんな書き方、とても面倒くさくないか??
だから、次のように考えていくのだ。塩化ナトリウムの結晶をよく見てみると、プラスのナトリウムイオンとマイナスの塩化物イオンがお互いのプラスとマイナスを打ち消し合って存在している。
ということは、ナトリウムイオンが1個なら塩化物イオンは1個存在し、ナトリウムイオンが100個なら、塩化物イオンは100個存在することになる。そこで、代表となるNa+とCl-を1つずつ取り出してNaClと表現するのだ。
ナトリウムイオンや塩化物イオンが何個あるかは、とりあえず置いといて、Na+とCl-が1対1の割合で結合するから、塩化ナトリウムはNaClで表現しようというわけだ。
こういうのを組成式という。
ここで整理しておくと、
イオン結晶はたくさんのイオンが相互に密接に結びついて存在している。その全てを書き出すと埒が明かないから、基準となる部分を取り出して表現するのだ。
□組成式の書き方
さて、それでは組成式の正式な書き方を塩化マグネシウムで順番に確認していこう。

まず1番目。陽イオン、陰イオンの順に並べる。
塩化マグネシウムは、陽イオンのマグネシウムイオンと陰イオンの塩化物イオンから出来ているからMg2+そしてCl―と並べる。
そして2番目。陽イオンと陰イオンの数の比を求める。
ここは、プラスとマイナスを併せて0になるようにする。マグネシウムイオンは1つでプラス2だ。それに対して塩化物イオンは1つでマイナス1だから、この場合はマグネシウムイオン1つに対して、塩化物イオンを2つ、つまり、1:2とする。
次に3番目。2番目に書いた比を元素記号の右下に書くのだ。
(ただし、数字の1は省略する。)
従って、完成した組成式はMgCl2となる。
さて、今日の講義はここまでにしておこう。皆の健闘を祈る。
■その他の講義はこちらのガイドを活用ください↓
■資料の閲覧とダウンロードはこちらより↓↓↓















