授業資料にある問題の解答はこちらを確認してください。
今から
2:金属をつくる元素(金属元素)には特有の性質がある。
3:金属元素と非金属元素の組み合わせによって、結合の種類が決定する。
という3つのポイントに沿って説明していこう。
ナトリウムと水の反応
さて、今回は、まずはこちらの実験を見てほしい。
机の上にあるシャーレには水を含ませたろ紙が敷いてある。
このろ紙にフェノールフタレイン溶液を含ませてから、ナトリウムの塊を乗せてみたい。
ナトリウムは危険物第3類の禁水性物質および自然発火性の物質であり、水と反応すると大量の熱と水素ガスを発生して水酸化物になる。取扱いに細心の注意が必要な物質だ。
どうだい??ナトリウムの危険性が伝わったかね。
これを数十kg、数百kg単位で取り扱うことためには、それぞれの物質の特徴をよく知っておかないといけない。
でないと、大惨事を巻き起こす危険性があるからな。
ナトリウムの火災に対しては、我々の常識は通用しない。
くれぐれもナトリウムに水を吹っ掛けないようにしてくれたまえ。
■ポイント1:金属結合とは
「金属結合とは、自由電子による金属の原子間の結合である。」
ということについて説明していこう。
ナトリウム原子は、K殻に2個、L殻に8個、M殻に1個の電子が存在している。
これを模型で示してみると、こんな感じになる。
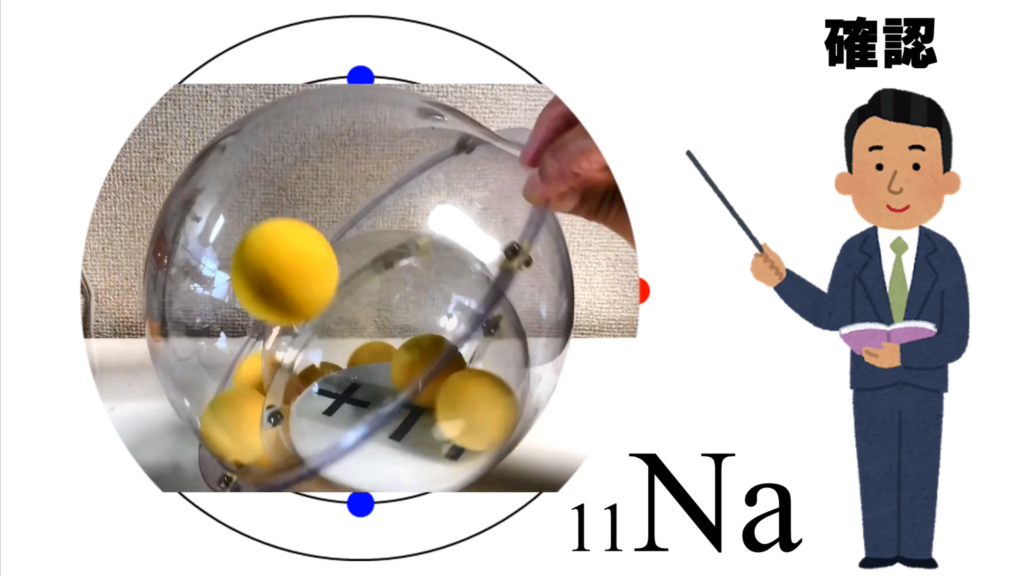
このプラス11というプレートは、ナトリウム原子の原子核だ。
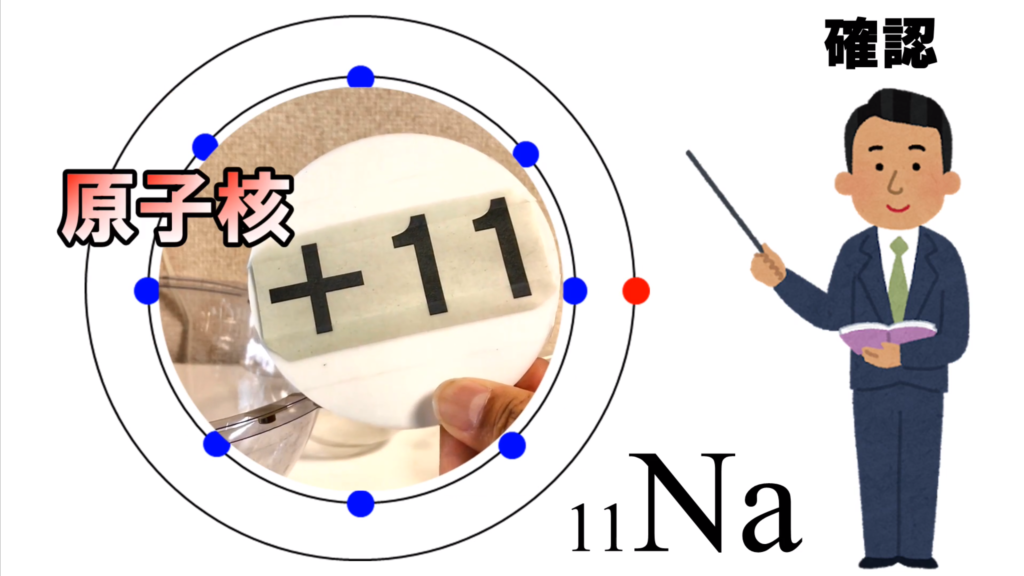
そして、原子核の外側に2つの電子が入ったK殻があって、
更に外側には8個の電子が入ったL殻がある。
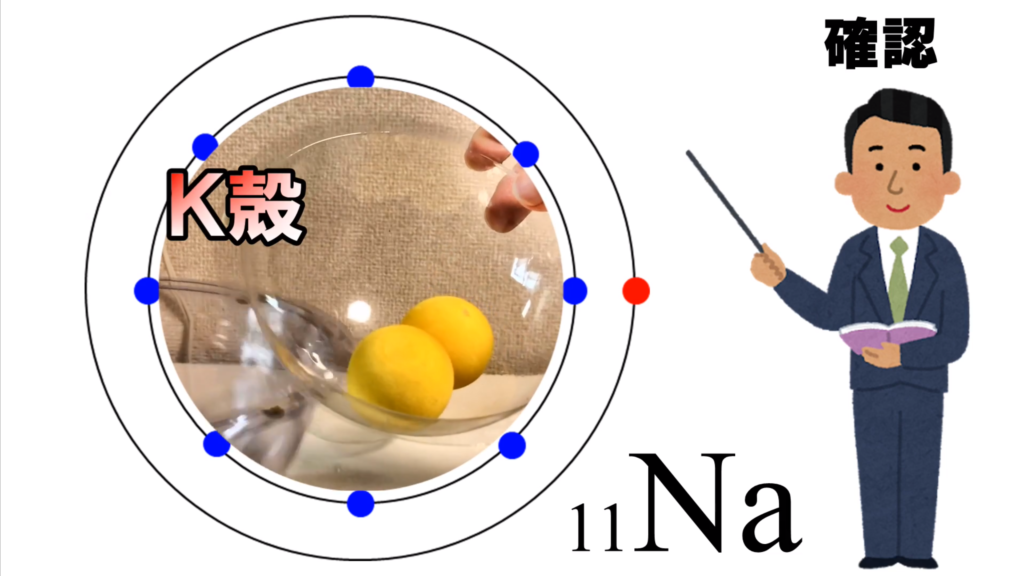
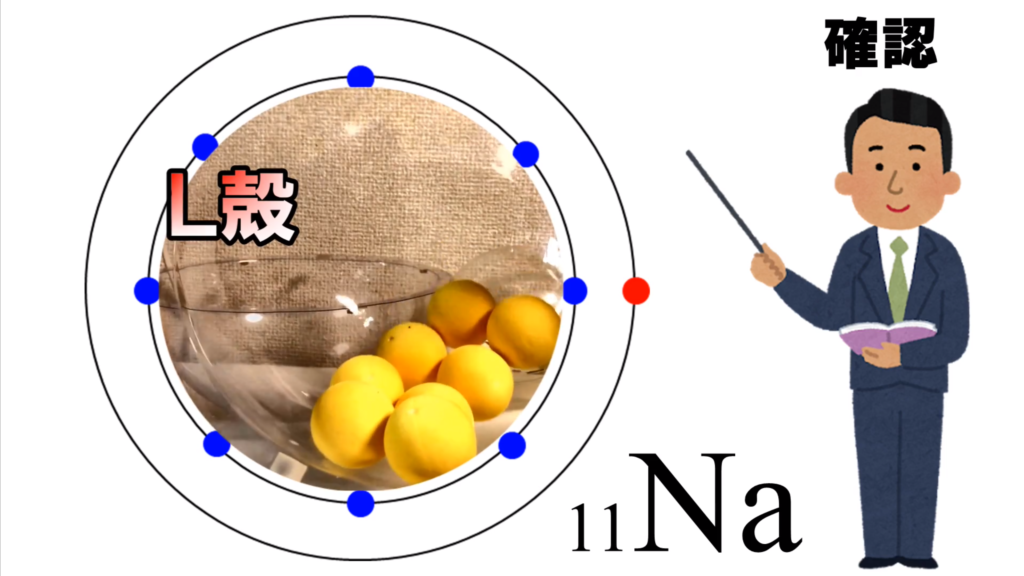
K殻とL殻には最大数の電子が入っているから、
電子殻は閉じられている。
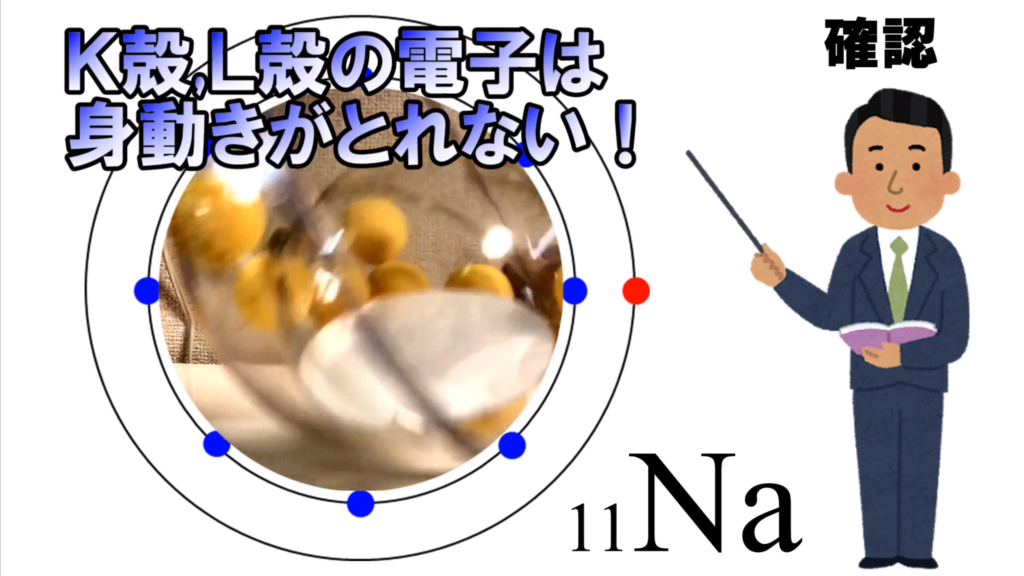
ここには、これ以上電子は入り込めないし、
中の電子は外に逃げられない。
それに対してM殻にある、この電子はどうだ。
M殻には、まだまだ電子が入り込む余地があるから
電子殻は開いている。
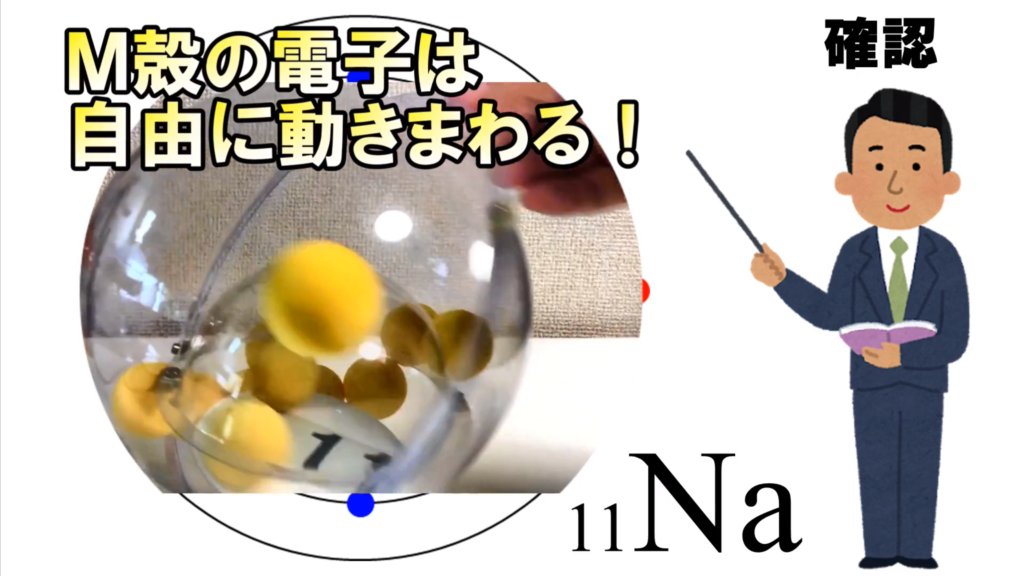
だから、他の電子に比べて、周囲を自由に動き回ることができる。
これが今回の重要なポイントになる。
今、画面には、ナトリウム原子が並んでいる。
ここでは、重要なところ以外を省いて表現している。
中心にあるプラスは原子核だ。
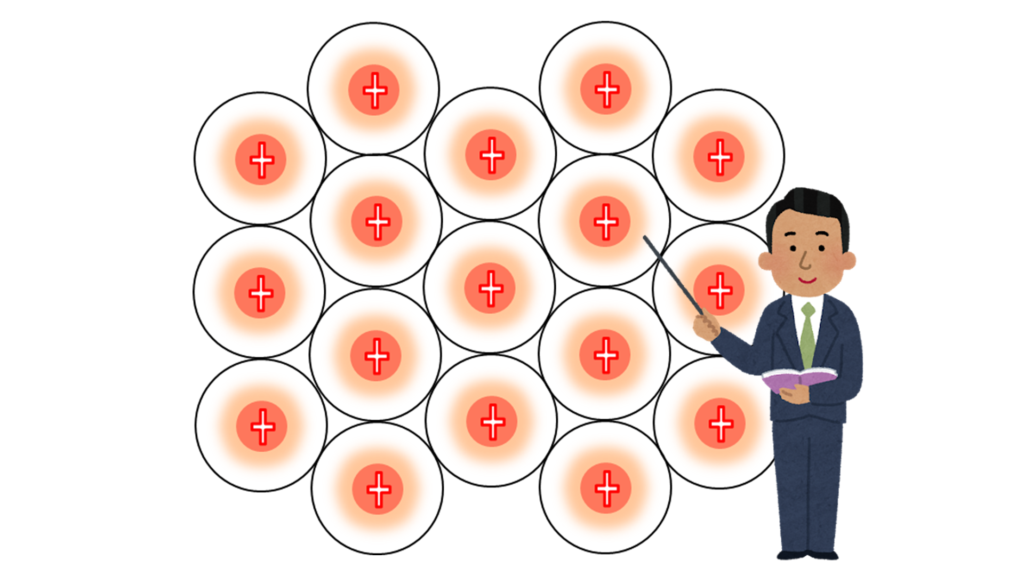
このままでは、ナトリウム原子は結び付かない。
それどころかプラスとプラスだから反発してしまう。
大切なものを忘れているな。そう。電子だ。
ここにナトリウムの最外殻電子がある。
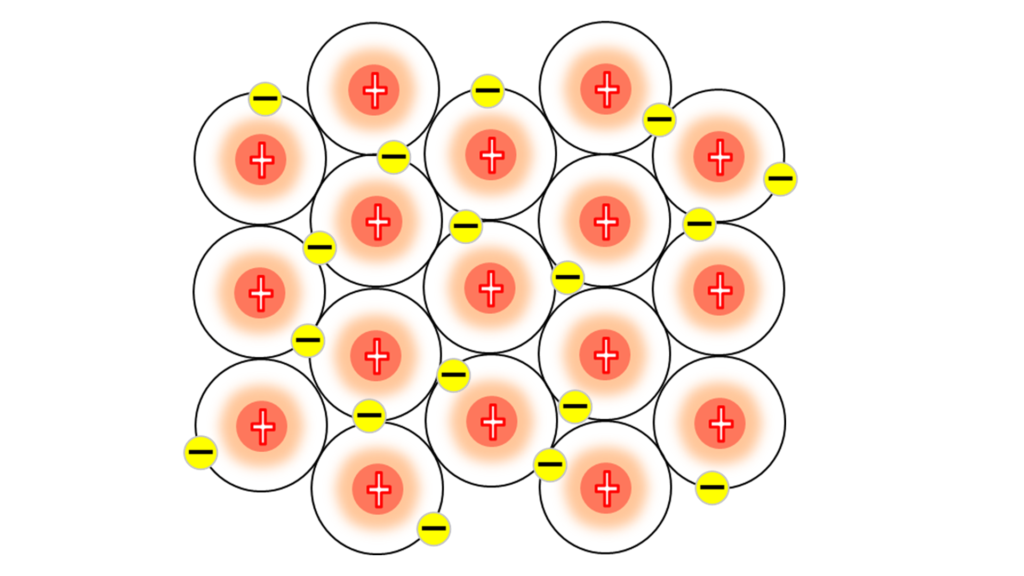
通常、電子殻に存在する電子は、電子殻の中をぐるぐる動きまわっているだけだが、
この最外殻電子は違う。
こうやって、自由に他の原子の最外殻を自由に動きまわる。
これによって、ナトリウム原子のプラスとプラスの間を
常にマイナスで補っているんだ。
この自由に動きまわっている最外殻電子の事を「自由電子」という。
自由電子が動きまわっていることによって、
ナトリウム同士の結びつきを生み出している。
結び付いているということは、そう、結合しているということだ。
つまり、金属同士の結合である
という訳だ。
自由電子は原子間を動きまわって接着剤のような役割を果たしているんだなぁ。
■ポイント2:金属結晶の性質
ここからは金属結晶の性質を確認していこう。
金属結晶の内部では、自由電子が動きまわっているため、特徴的な性質を示すのだ。
今から、その特徴を見ていこう。
1つ目、展性と延性がある。

金属の結晶を叩いたり、延ばしたりしても、結晶の内部では自由電子が新たな結合を形成するため、簡単に割れたり砕けてしまうことがない。
2つ目、電気伝導性があり、熱伝導性が大きい。

結晶内部の自由電子は、電気や熱のエネルギーを結晶全体にくまなく運んでくれる。
そのため、金属の結晶は、電気や熱をよく通す。
その他の性質として、金属特有光沢があること。密度が大きいこと。融点が高いことくらいを知っておけばよいだろう。
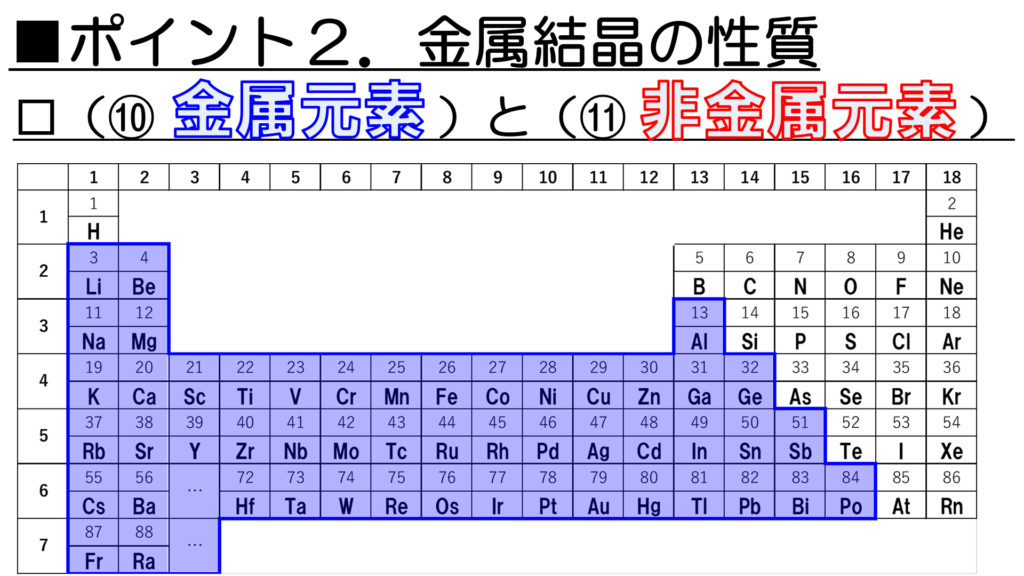
次に、金属特有の性質を示す金属元素と、金属の性質を示さない非金属元素を周期表で確認していこう。
金属の性質を示す元素はこちらに示すとおりだ。青色の部分が金属元素だ。
それに対して、非金属元素は青色以外の部分ということになる。
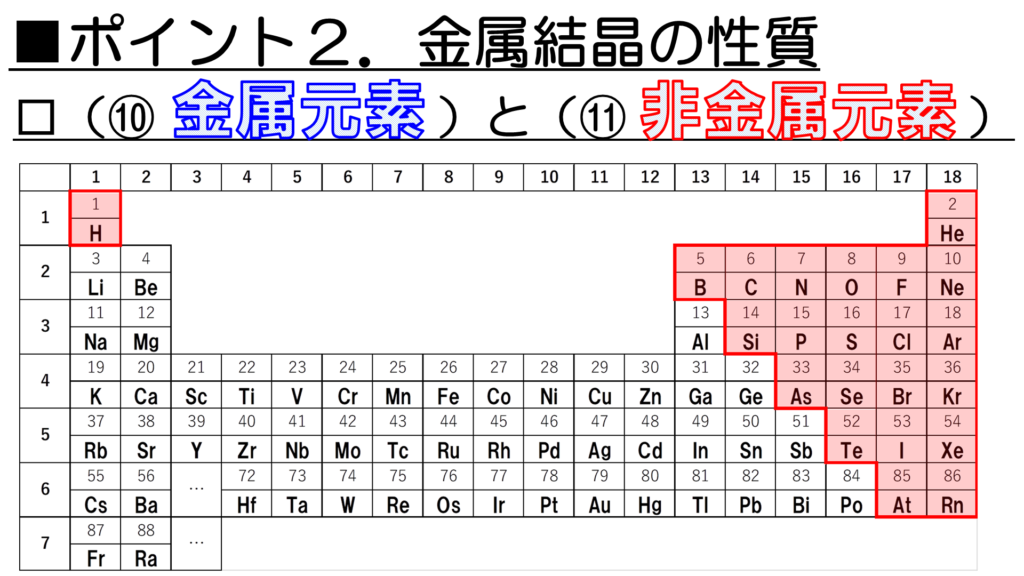
今、赤色で示しているのが非金属元素だ。左上の水素原子以外はまとまって分布しているなぁ。
意外かもしれないが、こうして周期表を眺めてみると、金属元素の種類の方が多いことが分かる。
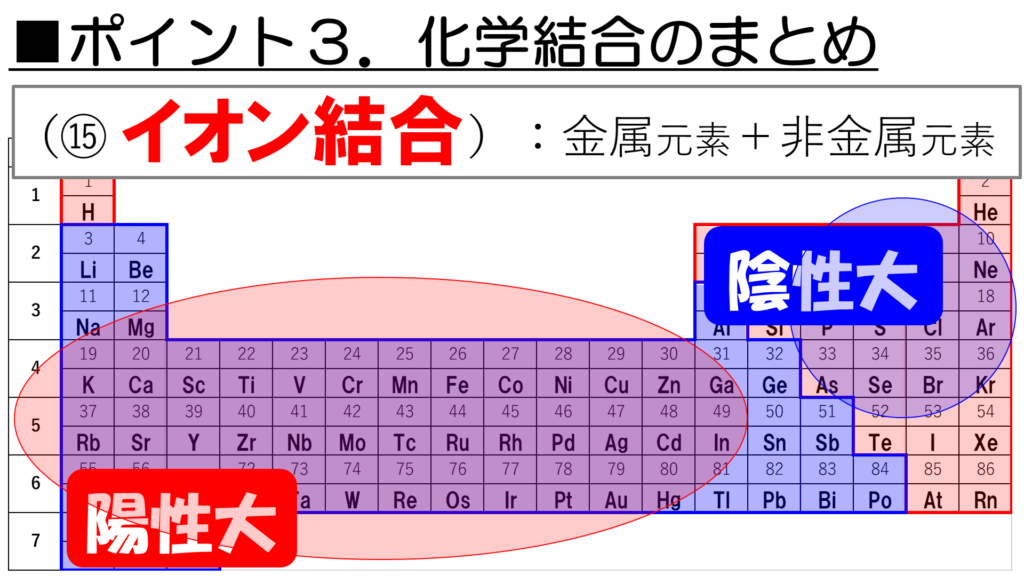
■ポイント3:化学結合のまとめ
それでは最後に、化学結合を整理して今回の授業を締めくくりたい。ここでは、周期表に並んでいる原子がどのような結合を作るのか、という大体の目安のつけ方について説明しよう。
その前に、一つだけ確認しておきたいことがある。それは、陽性と陰性についてだ。
陽性とは、価電子を失って、陽イオンになりやすい性質のこと。
それに対して、
陰性とは、電子を取り込んで、陰イオンになりやすい性質のことだ。
この陽性を示す元素は周期表の左下に多く、逆に陰性を示す元素は周期表の右上に多いことがわかっている。ただし、貴ガスは陰イオンにはならない安定な元素なので、陰性元素には含まれないことに注意し欲しい。
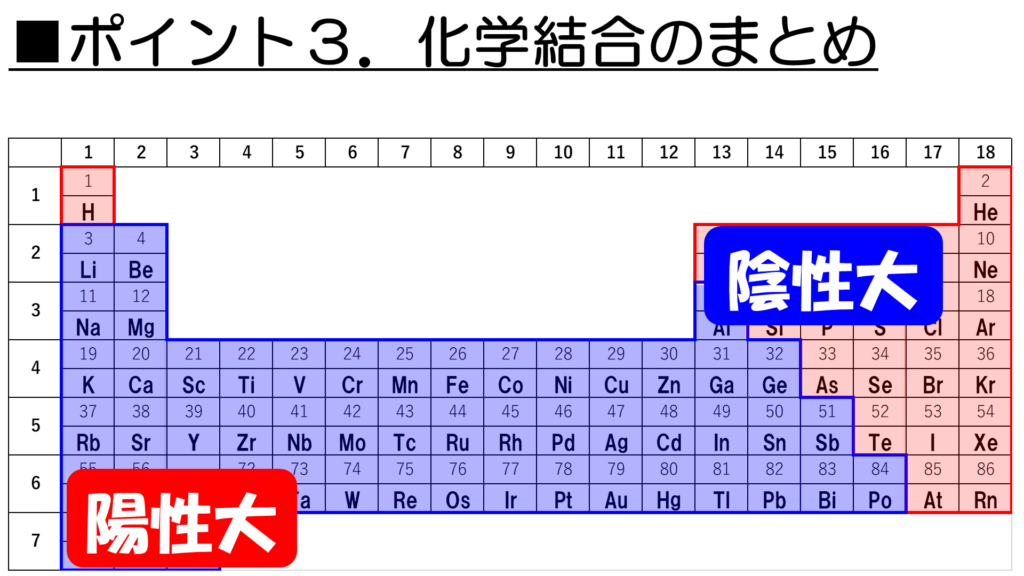
さぁ、それでは今回学習した、金属元素と非金属元素、そして陽性と陰性をもとにして、化学結合を整理していこう。
まず、金属元素同士が結合すると、今回学習した通り、金属結合を形成する。

次に、金属元素と非金属元素が結合するとどうだ。金属元素の大半は、陽性であり、非金属元素の大半は陰性であることを考えると、陽イオンと陰イオンによる結合、つまりイオン結合が形成されることが見えてくるなぁ。
最後に、非金属元素同士が結合すると、共有結合が形成される。
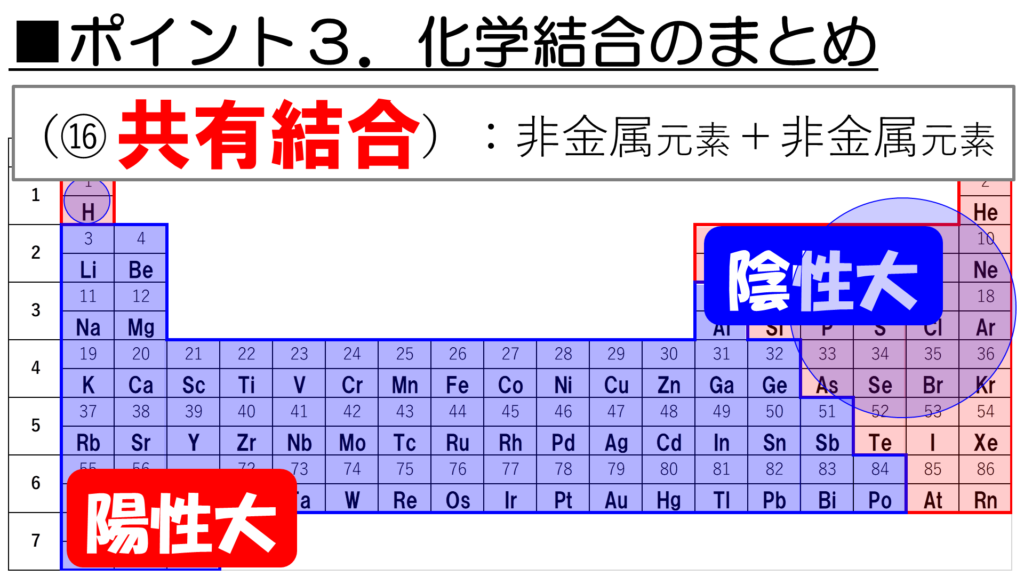
例えば、水H2Oなら、Hは非金属元素、Oも非金属元素、二酸化炭素CO2なら、CもOも非金属元素で、ばっちり条件を満たしていることがわかるな。
このように周期表を整理しておくと、どの元素がどのような結合を作るのか、1つ1つ暗記して覚えなくても、おおよその予測が立てられるのだ。
今回の授業はここまでだ。引き続き学習する諸君は、続きの問題編に進んでくれ給え。それでは、次の授業で、また会おう。