授業資料にある問題の解答はこちらを確認してください。
今回は、配位結合と特別なイオンについて話を進めて行こう。
さっそくだが、今日のポイントは、
2.酢酸イオンからなる物質の組成式の書き方は、通常のルールと異なる。
以上の2つだ。
■ポイント1:配位結合とは
それでは、配位結合とは、
「電子対が、一方の原子だけから提供されてできる共有結合」
であるということについて説明していこう。
1-1電子式の確認
まず電子式について復習しよう。
電子式は、電子配置図を描く代わりに、元素記号の外側に、最外殻電子を書き込んだものだ。
水素原子は電子の数が1個だから、このように元素記号の外側に「点」を書き込む。
窒素原子は原子番号7、電子の数は7個だが、最外殻電子の数は、L殻に入った電子の数だから5個。
だから、元素記号の外側へ順番に1つずつ「点」書き込む。4隅が埋まったから、最後の1個はペアを作るように書き込んでしまえばOKだ。
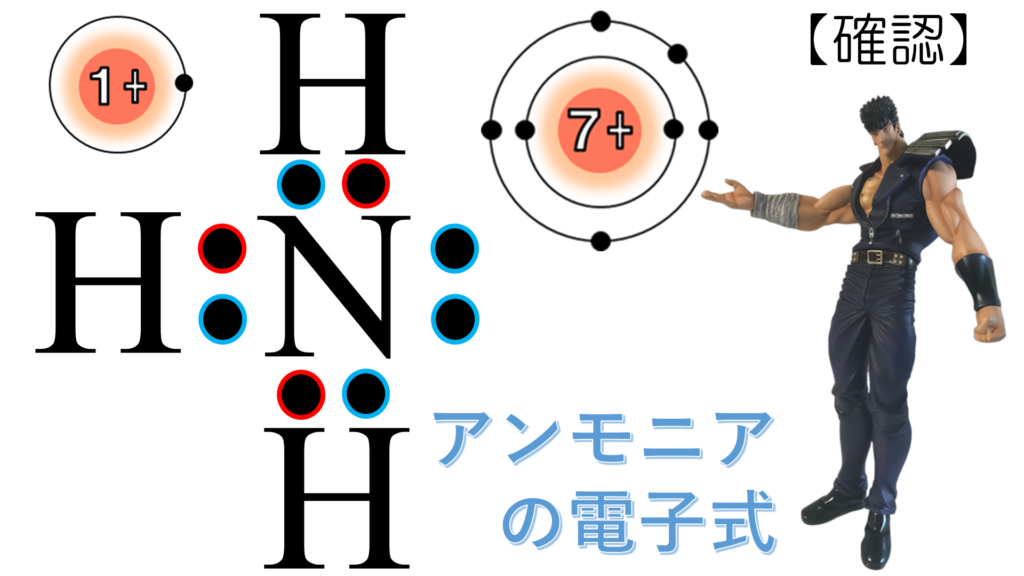
化学反応に関係するのは最外殻に存在する価電子だから、このように表現すると、共有結合の様子が分かりやすくなる。こうしてできた分子がNH3、アンモニア分子だ。
今回の配位結合は、共有結合している電子対ではなく、結合に関わっていない非共有電子対が主役になる。
1-2配位結合
このアンモニア分子の近くに水素イオンがやってきたとする。
水素イオンを電子配置図で表現すると、このようになる。
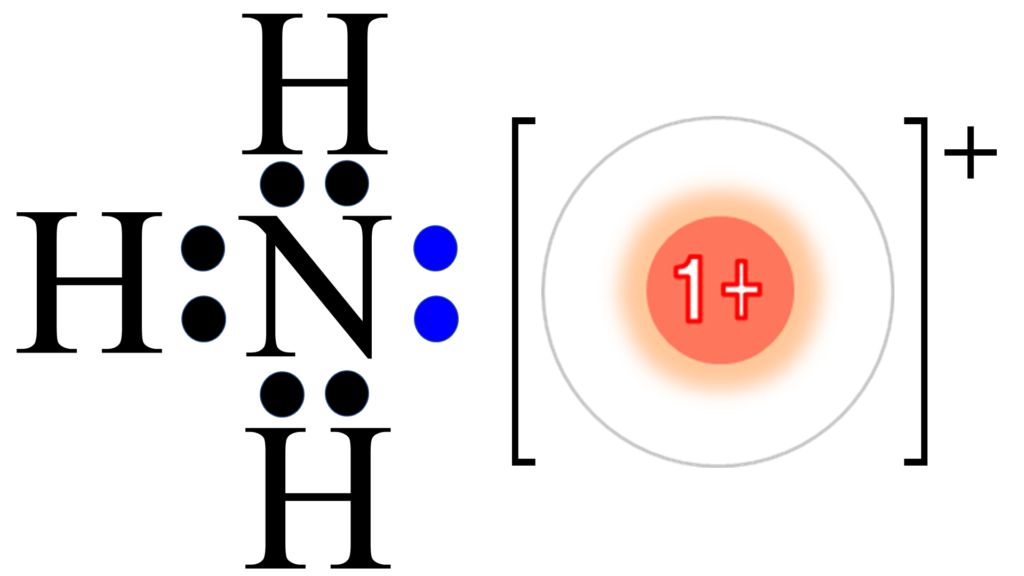
図を見れば分かるように、水素イオンは電子を持っていない。
この時、隣にある窒素の非共有電子対が、水素イオンの電子殻に侵入する。
すると、何と、ヘリウム原子と同じ安定な電子配置になるではないか。
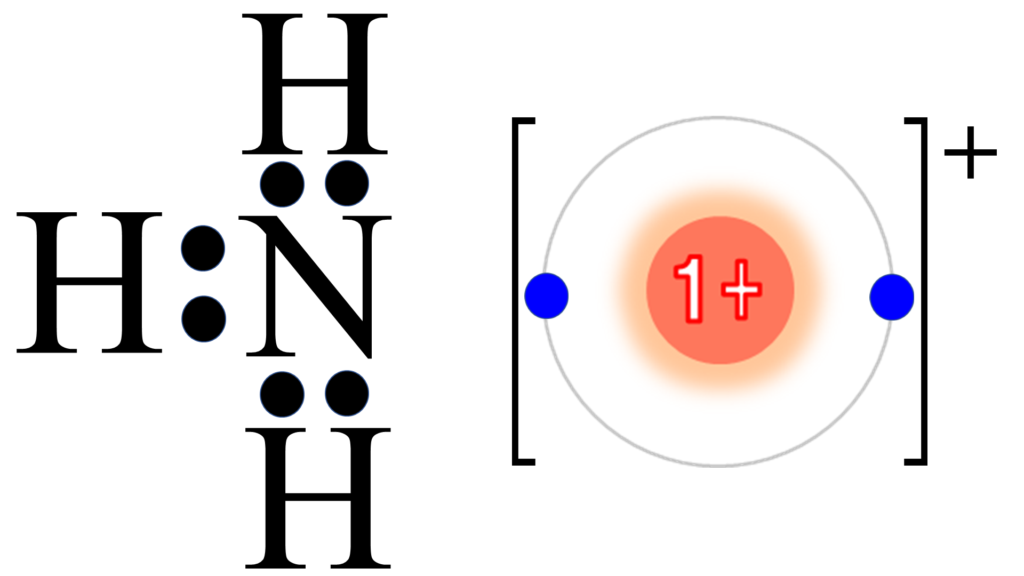
このような事情から、アンモニア分子と水素イオンが接近すると、次のように水素イオンがアンモニア分子に取り込まれる。こうして出来たものがアンモニウムイオンNH4+だ。

この時、アンモニア分子の非共有電子対によって出来た結合を配位結合という。
整理しておくと、配位結合とは、
であるということだ。
それではもう一つ確認しておこう。
こちらに水分子がある。水分子には、非共有電子対が2つある。この水分子と水素イオンが接近すると、配位結合を形成する。こうして出来たものが、オキソニウムイオンH3O+だ。
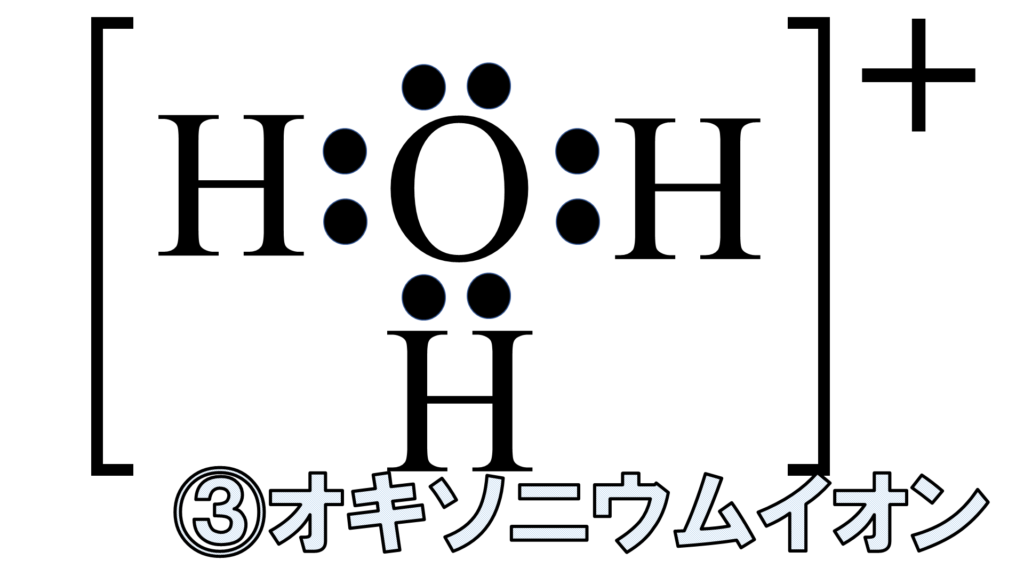
■ポイント2:特別なイオンについて
次のポイントに移ろう。ここでは、酢酸イオンからなる組成式と水素イオンにまつわる、2つの注意点について説明しよう。
2-1酢酸イオンからなる組成式
まず1つ目だが、以前、イオンからなる物質の命名方法と組成式について学習したなぁ。
例えば、ナトリウムイオンと塩化物イオンからなる物質は、静電気力で引き合ってイオン結合する。
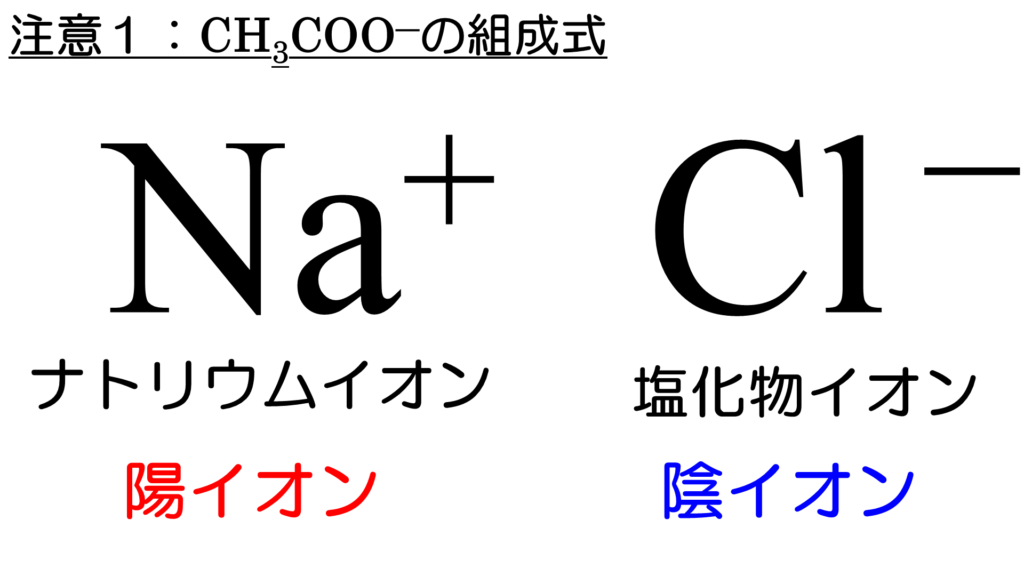
その時に出来た物質は、陰イオンから先に読み上げて、塩化ナトリウムと名付ける。
化学式で表現する時は、陽イオンを先に書いて、NaClとする。これを組成式と言ったわけだなぁ。

名前を付ける時は、陽イオンが先、組成式を書く時は、陰イオンが先というのが、基本的なルールになるが、例外が存在する。それが酢酸イオンからなる物質だ。
酢酸イオンは陰イオンで、これを構造式で示すと、このようになる。
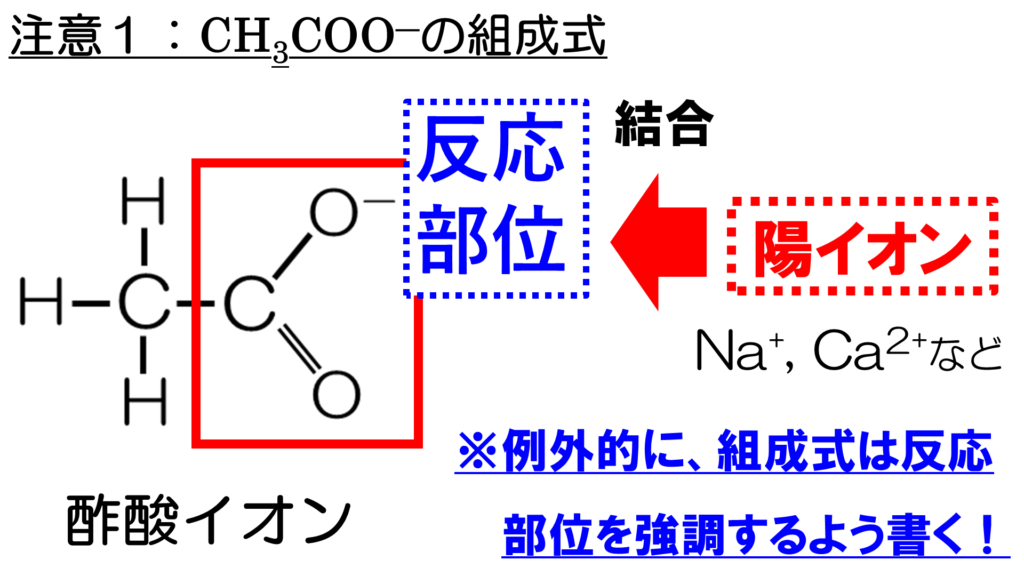
酢酸イオンは、右側のO-の部分が陽イオンと反応して、イオン結合を形成する。これを組成式で表現する時、陽イオンと反応する部分を誤解しないようするために、酢酸イオンのイオン式CH3COO-の右側に陽イオンを書かなければならない。
例えば、ナトリウムイオンNa+とイオン結合する時は、基本的なルールに従えば、NaCH3COOと書く。しかし、これだとナトリウムイオンが炭素にイオン結合していると誤解する恐れがある。だから、実際は反応部位を強調するために、CH3COONaとして、これを酢酸ナトリウムという。名前のつけ方については、従来のルール通りだ。
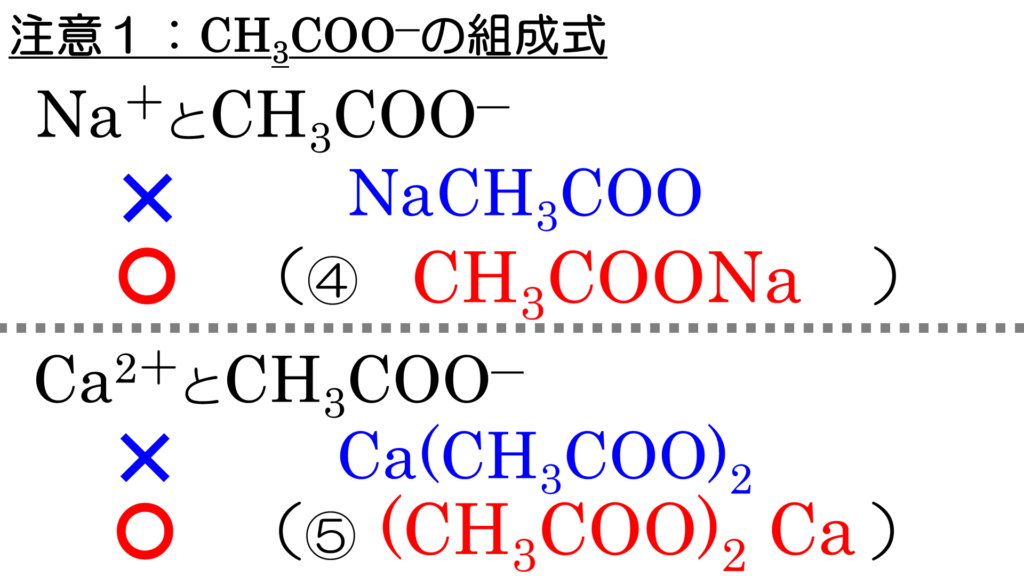
同じように考えて、カルシウムイオンCa2+とイオン結合する時は、Ca(CH3COO)2と書くところを、実際は、(CH3COO)2Caとする。
2-2水素の陰イオン
次に2つ目の注意点だが、実は、水素原子は陽イオンだけでなく、陰イオンになることがある。
通常、水素原子は、電子を1コ失ってプラスの電荷を持った陽イオンとなり、マイナスの電荷を持つ陰イオンとイオン結合する。
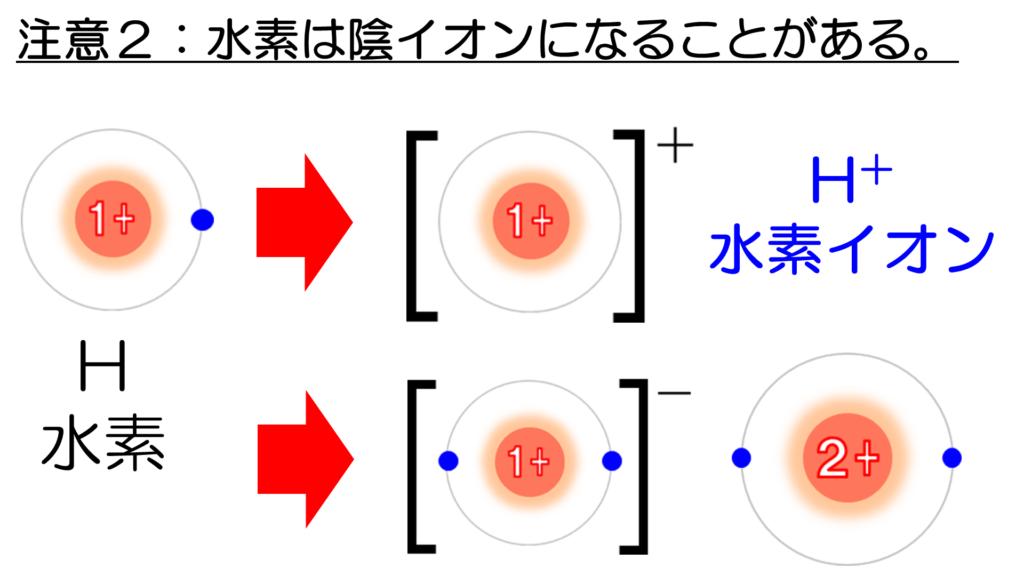
しかし、水素原子が電子を1コ取り込むと、電子の数が2コになって、安定な貴ガスのヘリウム原子と同じ電子配置になる。このとき出来たイオンを水素化物イオンという。
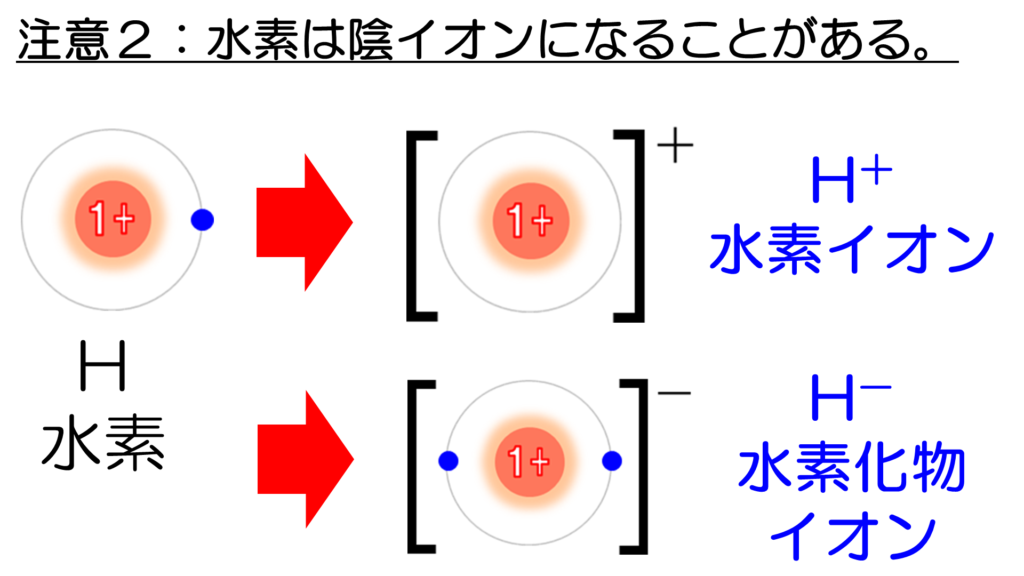
例えば、水素原子は、陽性の強いナトリウム原子に出会うと、電子を1コ奪いとって、水素化物イオンになる。この時、Na+とH-が結合した物質は、水素化ナトリウムと言って、危険物第3類に分類される。

◎異なる単元の学習は、こちらのガイドを活用ください。