授業資料にある問題の解答はこちらを確認してください。
それでは、今日の講義を始めよう。
■ポイント1:構造式とは
1-1電子式の復習
今回は構造式について進めて行く予定だが、
その前に電子式の復習から始めよう。
さぁ、画面にある3つの分子の共有結合を電子式で表現してみようではないか。
電子式は、元素記号の外側に最外殻電子を書き込むのだったなぁ。
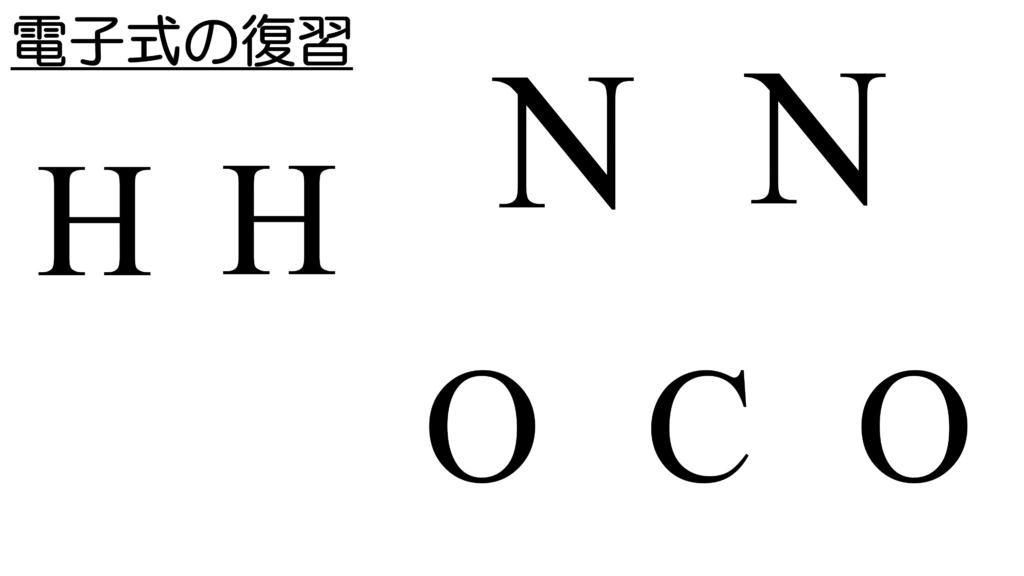
水素原子は、お互いの最外殻電子を共有すると、ヘリウム原子と同じ安定な電子配置の水素分子になる。
二酸化炭素だと、酸素と炭素がお互いの最外殻電子を2つずつ共有することで、ネオン原子と同じ安定な電子配置になる。
最後の窒素分子は、このようになる。

ところで、電子配置図で表現することを考えたら、電子式はシンプルな表現方法ではあるが、それでもなかなか面倒な代物だ。
そこで、今回は、電子式よりも、もっと簡単な表記方法を紹介しよう。
1-2構造式
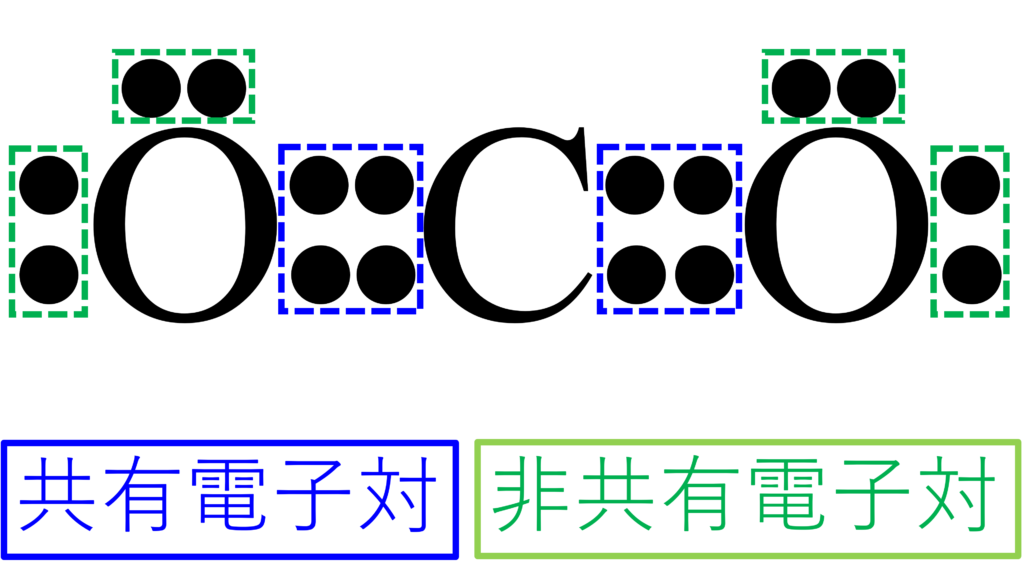
では、まず、CO2の電子式を見てもらおうか。
共有結合に関係しているのは、こちらの共有電子対たちだ。
酸素の周囲にある2組の電子対は、共有結合には関与していない。
結合に関与していない電子のことを非共有電子対という。
さぁ、そこで出てくるのが、今回紹介する構造式だ。
それがこちらだ。
おぉ~、こっ、これは。
我々が求めているのは、これだけだったのか!?
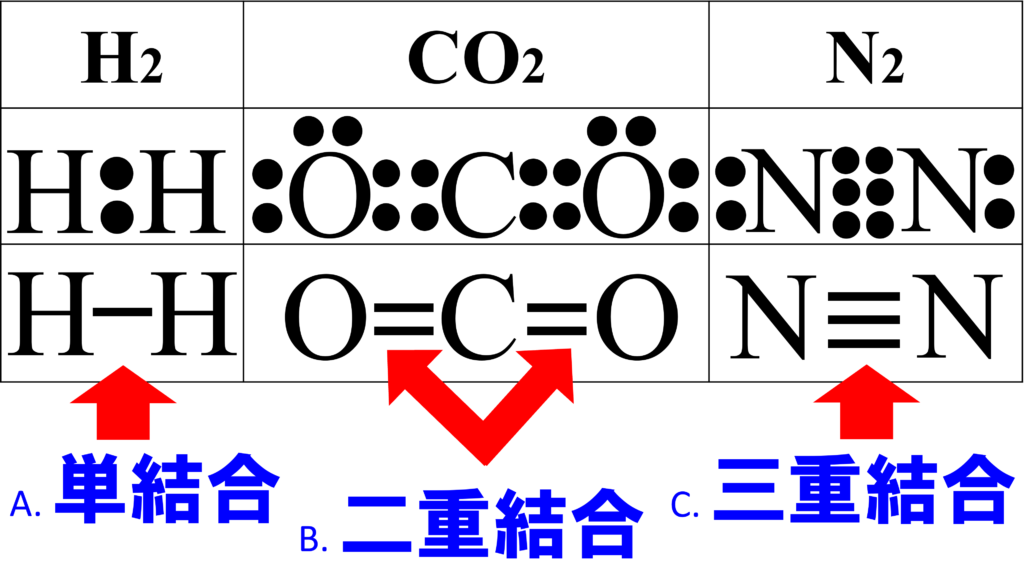
構造式においては、ここの電子対、つまり非共有電子対は必要としないから、全て省略するのだ。
そして、共有電子対の分だけ、棒を入れるのだ。
ちなみに、1本線を単結合、2本線を二重結合、3本線を三重結合という。
つまり
ということで、とてもシンプルになっている。
これを使えば、共有結合の様子がわかる最強の表現方法だ。
この構造式の書き方、しっかりと理解してもらいたい。
■ポイント2.分子結晶
それでは、ここからは共有結合した物質が作る結晶について、説明していこう。
まずは、分子結晶からだ。
こちらを見てもらいたい。この二酸化炭素が充満した袋を液体窒素の中に入れて、冷却していく。
そうするとどうだ。二酸化炭素同士が結合して、二酸化炭素の結晶、つまりドライアイスが誕生するのだ。
二酸化炭素同士を結び付けるこの力のことを、分子間に働く力ということで、分子間力という。別名ファンデルワールス力ともいう。
冷たい北風が吹く荒れる冬場は、あまりの寒さに身体が震え縮こまり、お互い身を寄せ合い、ぶるぶると暖まる・・・。分子結晶は、そんなイメージにぴったりだなぁ。

この分子からなる結晶は、ドライアイスの他にうがい薬に含まれるヨウ素や防虫剤の成分であるナフタレン、パラジクロロベンゼンがある。

これらに共通する性質として、軟らかくもろいことと、電気伝導性が無いことが挙げられる。
ドライアイスの固体は常温で放っておくと、すぐに気体の二酸化炭素になってしまうように、結合力はとても弱い。それが軟らかくもろいという性質に繋がっているわけだ。
分子結晶は、一般的に融点が低く、ヨウ素やドライアイスなどでは、固体から気体へと液体の状態を経ずに状態変化する。この状態変化のことを「昇華」という。この言葉は、とても重要なのでしっかりと覚えてもらいたい。
■ポイント3.共有結合の結晶
次に進もう。
ここにダイヤモンドの結晶がある。

透き通るような透明感とまばゆい輝きを放つダイヤの原石。ダイヤモンドは知っての通り、炭素原子から出来ている。これを部分的に拡大してのぞいてみよう。すると目の前にはこんなイメージが広がっている。
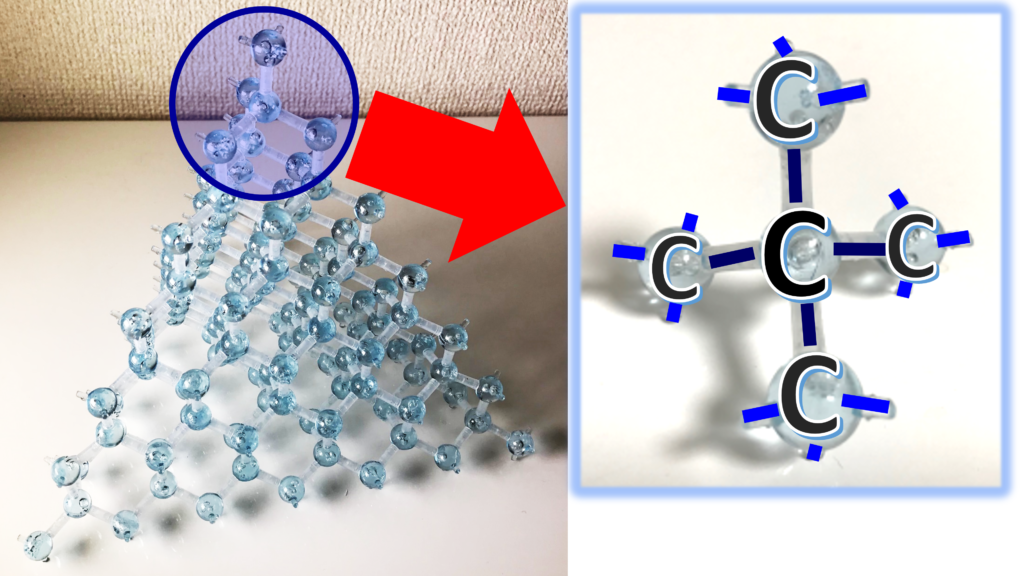
どうだい?水色の玉の炭素原子が規則正しく並んでいるだろう。ダイヤモンドの美しさは、この炭素原子の規則正しい配列によるものだったのだ。この炭素原子の結晶においては、炭素原子同士がお互いに共有結合で結びついて無限に広がっている。
このように
共有結合の結晶は、ダイヤモンドや黒鉛に加えて、二酸化ケイ素から出来た水晶などがある。
これらの結晶に共通する性質は、非常に硬く。融点は極めて高い。融解しても電気伝導性はない。ということが挙げられる。
ただ、1つだけ例外があって、黒鉛は共有結合をしているが、少しばかり特徴的な結合をしているので、電気伝導性があり、柔らかいという特殊な性質を持っている。これについては、また機会があれば説明することにしよう。
さて、今回の授業はここまでとなる。もう一度、振り返っておくと、

共有結合を最もシンプルに表現できる方法として構造式を確認した。
それから、共有結合に関わる結晶として分子結晶と共有結合の結晶について確認してきた。分子結晶は、共有結合によって出来た分子同士が弱い力で結びついた結晶。
共有結合の結晶は、原子同士が共有結合による強い力で結びついた結晶であるところに注意してほしい。
それでは、続きの問題編に進んでくれ給え。次の授業で、また会おう。