
目次
はじめに
今回は質量パーセント濃度の公式を使った濃度計算の演習をやってみよう。今回の内容は、危険物の試験には直接関係しないが、君たちがこの先受けるであろう就職試験の一般教養として問われるから、この際是非マスターしてもらいたい。
※資料のダウンロードはこちらからお願いします。
■No.02 濃度計算:質量パーセント濃度の問題演習①
■No.03 濃度計算:質量パーセント濃度の問題演習②
※動画による学習はこちらをクリックしてください↓↓↓
※授業資料にある問題の解答はこちらを確認してください。
■No.03 濃度計算:質量パーセント濃度の問題演習①【解答】
■No.03 濃度計算:質量パーセント濃度の問題演習②【解答】
今から3つのタイプの問題を解いていく。その3つとは、
2つ目が、濃度の異なる溶液を混合するタイプの問題。
3つ目が、溶媒を蒸発させるタイプの問題
である。
では、順番に見ていこう。
濃い溶液を薄め、目的の濃度の溶液を作るために、加えた溶媒の質量と薄める前の溶液の質量を求めるタイプの問題
どうだい?すぐに答えが求められるかな??
質量パーセント濃度の公式を使うことはわかっていても、何から手をつけていいのかわからない人は、いないかね。心配することはない。今、私の解説を聞かずに、答えを即座に導き出せる人は天才だ。
いいかい。こういう時は、焦らずにゆっくりと問題の状況を整理していくんだ。面倒臭がったらダメだぞ。
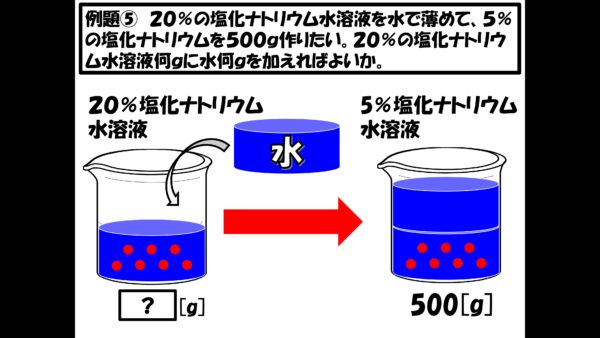
まず、最初に20%の塩化ナトリウム水溶液があると言っているのだなぁ。この水溶液が今何gあるのかはわからないが、これに水を加えると、5%の塩化ナトリウム水溶液500gに変身するという訳だ。
さぁ、諸君なら、ここからどうするかね。
とりあえず、20%の塩化ナトリウム水溶液を質量パーセント濃度の公式で、表現してみよう。
今、溶質の質量はわからないから、分子は[?]としておこう。そして、溶液の質量をこれから求めないといけないから分母は X とする。これに100を掛けたら20パーセントになると言っているわけだ。
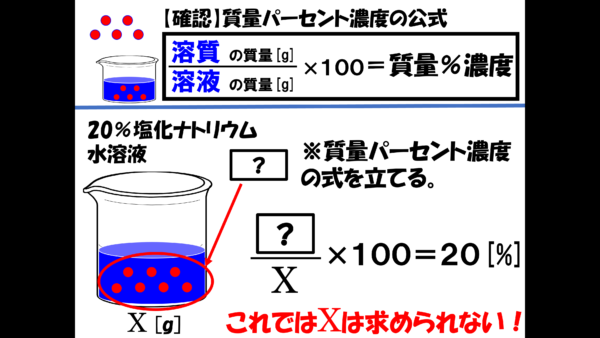
しかし、この式ではまだ X が求められない。20%の水溶液のことをこれ以上考えても進展がなさそうなので、次に5%」の塩化ナトリウム水溶液について同じように式を立ててみる。
相変わらず溶質の質量はわからないから、分子は[?]だ。しかし、分母にくる溶液の質量は500gで、それに100を掛けたら、5%になることがわかっているんだ。
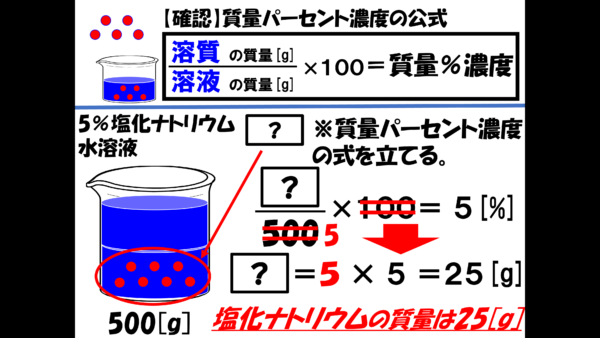
おぉー、この式を使えば、[?]が求まるではないか。これを計算したらどうなる。結局 ? に入る数字は25になり、溶質の質量、つまり塩化ナトリウムの質量は25gであることがわかる。
では、もう一度20%の水溶液の方を考えてみよう。20%の水溶液に水を加えて5%の水溶液が誕生した。この2つの図をよく見てもらいたい。
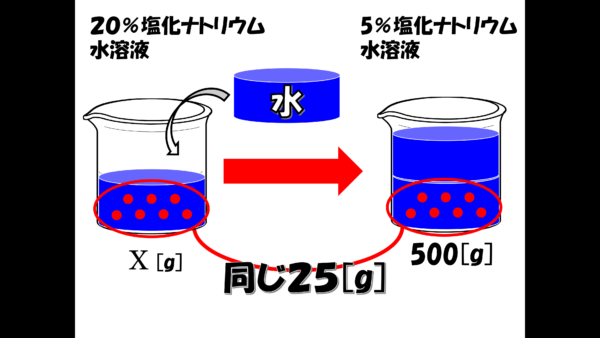
水を加える前後で、塩化ナトリウムの量は変わっていない。だから、最初に立てた式の[?]には25が入る。これでxが求まらないかね。一度計算してみたまえ。計算したら答えは X は125、つまり20%塩化ナトリウム水溶液は125gであることがわかる。
さぁ、後は加えた水の量を求めるだけだ。
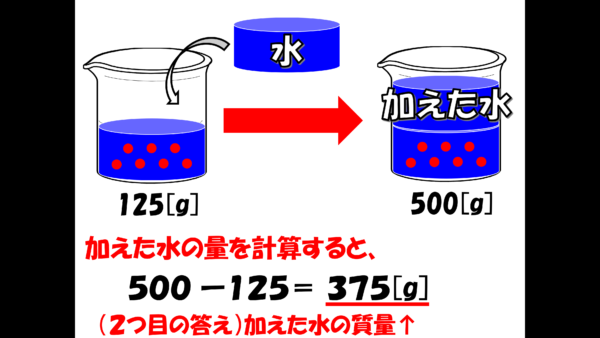
125gの水溶液に、水を加えたら500gになったという訳だから、もう君たちなら大丈夫だろう。加えた水の量は500-125で375gとなる。
それでは、次行ってみよう。
濃度の異なる溶液を混合するタイプの問題
早速だが、質量パーセント濃度の公式から考えてみよう。
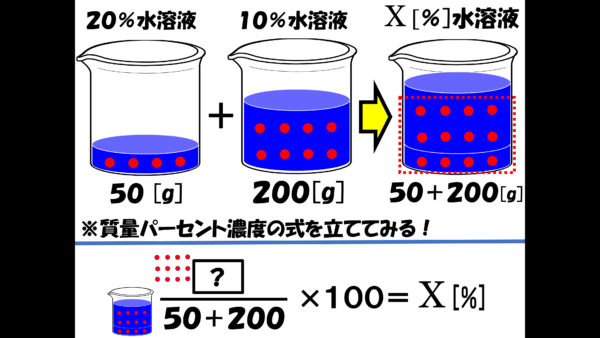
問題文には、溶質の量は与えられていないから、とりあえず分子は[?]としておこう。分母の溶液の質量だが、50gの水溶液と200gの水溶液を混ぜた訳だから、50+200で250gとなる。それに掛ける100を計算したら、答えが求められることになる。
こうして眺めてみれば、溶質の質量さえ分かれば、答えが求められるということがわかるだろう。
それでは、今から溶質の質量を求めていこうではないか。
さぁ、50gの水溶液に含まれる溶質の質量と200gの水溶液に含まれる溶質の量をそれぞれ求めてみたまえ。すぐに計算できる人は、早速やってみるのだ。計算方法を確認したいと言う人は、そのまま画面に注目してくれたまえ。
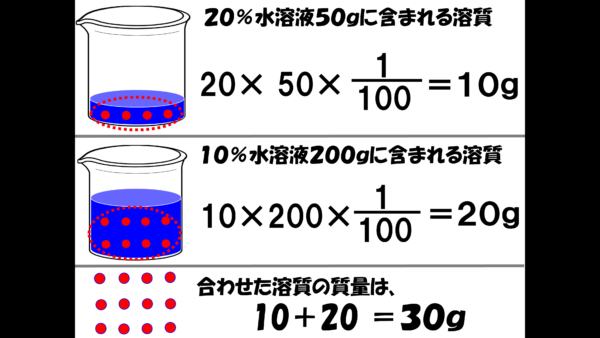
20%の塩化ナトリウム水溶液50gに含まれる溶質、つまり塩化ナトリウムの質量は、
50×20×100分の1=10gだ。
一方、10%の塩化ナトリウム水溶液200gに含まれる溶質の質量は、
200×10×100分の1=20だ。
したがって、2つの水溶液を混合した時の、溶質の質量は、10+20=30 となる。
これをさっき立てた質量パーセント濃度の式に代入しようではないか。
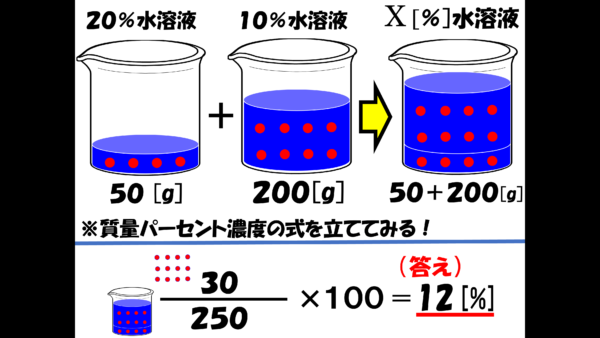
そうすれば、計算式は、250分の30×100となって、答えは 12%となるのだ。
どうだい? 出来たかね。
それでは、次の問題に行こう。これが最後だ。
溶媒を蒸発させるタイプの問題
今、10%の塩化ナトリウム水溶液500gがあるわけだが、水だけが50g蒸発してしまい、少しだけ水溶液が濃くなってしまったというわけだな。
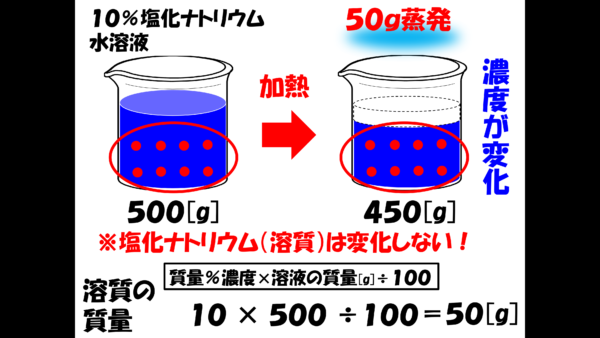
従って、水溶液は500gから450gになったということだ。
しかし、塩化ナトリウムは蒸発しないから、質量は変化しない。 最初に何gあったのか計算してみよう。
塩化ナトリウムの質量は、10×500×100分の1で計算できて、50gとなる。
ここまで出来たら後は、答えを求めるだけだ。
質量パーセント濃度の公式を使おう。
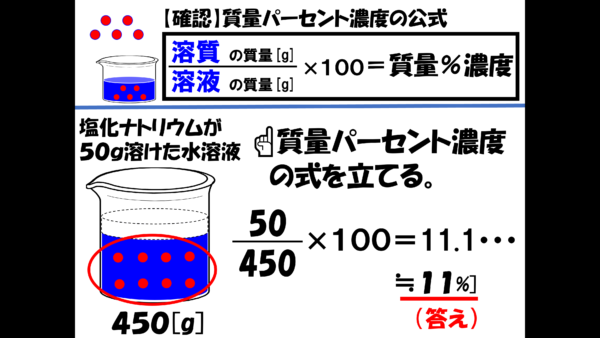
450分の50×100は、11.1・・・・%で、小数点第1位を四捨五入すると、答えは11%ととなる。
どうかな?出来たかな。
今回は、少し複雑な問題だったが、丁寧に考えていけばきちんと解答にたどり着けるから、一度自分で手を動かして計算練習してみるといい。
今回の講義はここまでだ。それでは、皆の健闘を祈る。
■その他の講義はこちらのガイドを活用ください↓















