
はじめに
今回は濃度計算について説明しよう。そもそも濃度というと文字通りものの濃さを表すんだ。そして、濃度計算とはものの濃さを数字で表現するということだ。難しく考えることはない。今朝の食事で味噌汁を食べてきた人もいるだろう。この味噌汁の味付けが薄いとか濃いというのを数字で表すというわけだ。その代表的な計算式が質量パーセント濃度の公式だ。今から、この公式について説明を進めていこう。
※資料のダウンロードはこちらからお願いします。
※動画による学習はこちらをクリックしてください↓↓↓
※授業資料にある問題の解答はこちらを確認してください。
ポイント1:3つの用語を押さえる
公式を説明する前に、みんなに押さえてもらいたい3つの用語がある。この用語があやふやだと、自由自在に公式が使えなくなるから完璧に理解してもらいたい。
それでは説明しよう。まず塩とか砂糖を溶かす状況を考えてもらいたい。これから溶かすもの、この粒々をイメージしてみたまえ。こういうものを溶質というのだ。逆に溶かすものは溶媒という。そして、溶質が溶媒に完全に溶けたものを溶液というのだ。
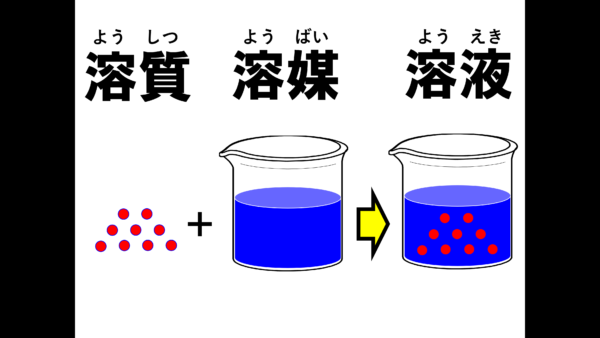
みんなには、この用語を完璧に使い分けられるようになってもらいたい。
ところで、みんなは塩を溶かす時に溶媒として何をイメージしたかね。水をイメージをした人が多いのではないかな??物を溶かす時、多く場合、水が使われるから、その場合、この溶液のことを水溶液というのだ。日常生活の範囲では、溶かすものとしてほとんど水を利用することになる。しかし、危険物を取り扱うようになってくると、水以外の溶媒を取り扱うことになってくるのだ。
では、これらの用語を完璧に使い分けて、質量パーセント濃度の公式を見ていこう。
ポイント2:質量パーセント濃度の式を確認する
質量パーセント濃度の公式は、溶質の質量を溶液の質量で割ったものをさらに100倍したものだ。100倍とはつまり、100をかけるということ。そして、ここでは割り算を分数で表現している。
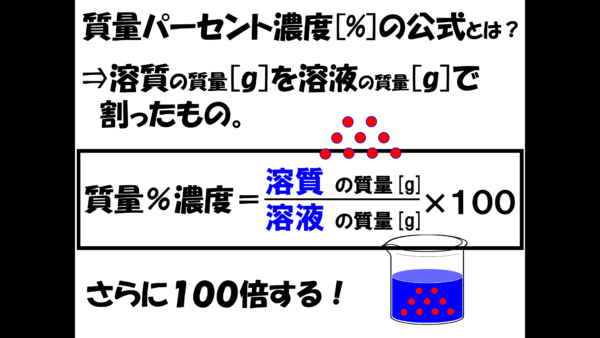
さぁこれから公式を使って計算しよう・・・と言いたいところだが、もう少し質量パーセント濃度の公式について考えておきたい。実は、溶液の濃さというのは、溶質の質量を溶液の質量で割ってしまえば表現できるんだ。
例えば、2gの塩が溶けた100gの塩水の濃さは、2÷100で0.02、
20gの塩が溶けた100gの塩水の濃さは、20÷100で0.2となる。
0. 02よりも0.2の方が数字が大きいから、20gの塩が溶けた塩水の方が濃いということがわかる。では、なぜ100をかけているのか?ということを皆には知っておいてもらいたいんだ。
今、2種類の計算をして、0.02と0.2という結果が求められたが、どうだい?みんな?
少数ってわかりにくくないか??
そこでだ。今求めた計算結果に100をかけてみたらどうだね??
2gの場合だったら2、20gの場合だったら20となるから、2つの数字の大きさを比べ安く
なったのではないかな??

みんなは今まで100点満点のテストを受けてきたから、100という数字には慣れているだろう。100点満点中、80点という具合に、全体を100としたら80含まれているという風に考えられると、スッキリしていて、とても便利なんだ。
ちなみに、このように全体を100とした時、いくつに相当するかという割合のことを百分率という。
さぁ、それでは実際に計算してみよう。
ポイント3:実際に式を使って計算する
確認だが、科学の世界では、塩(食塩)のことを塩化ナトリウムと言う。つまり塩化ナトリウム水溶液とは食塩水のことだ。
パッと数式が立てられる人は、私の解説を待たずに計算を進めてみたまえ。
質量パーセント濃度の公式を使うと、分数の分子には溶質の質量が入って、分母には溶液の質量が入る。だから計算式は、200分の30そして掛ける100となる。これを計算すると、答えは15%になる。

単位のパーセントを書き忘れないようにしてほしい。単位がないと、何を求めたのかがわからなくなるのだ。200分の30掛ける100イコール15と書かれても、質量を求めているのか長さを求めているのか、さっぱりわからない。
そこで15%とと書くと、これは塩化ナトリウム水溶液全体を100gとした時に、塩化ナトリウムが15g溶けていると理解できるのだ。
それでは、次に行ってみよう。
さっきと考え方は変わらない。溶質の質量は50gだ。溶液の質量は、200gの水に50gの塩が溶けているから、200+50と書ける。最後に100を掛けたら答えは、20パーセントだ。
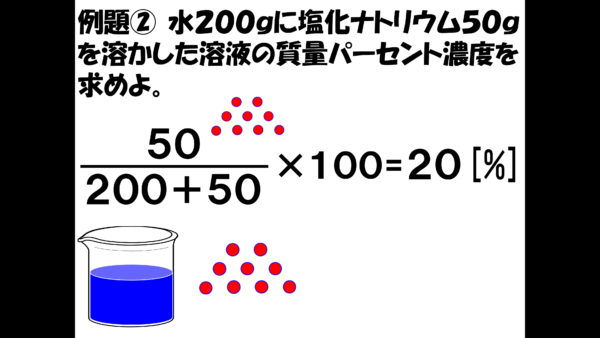
さて、ここでもう一度公式に戻って整理をしておきたい。
さっきの問題では、「溶液の質量を溶媒の質量」+「溶質の質量」で表現したから、質量パーセント濃度の公式は、「溶媒の質量」÷「溶質の質量」分の「溶質の質量」×100ともかける。
溶液の質量がわからない時は、溶液の質量を求めてから計算することになるのだ。
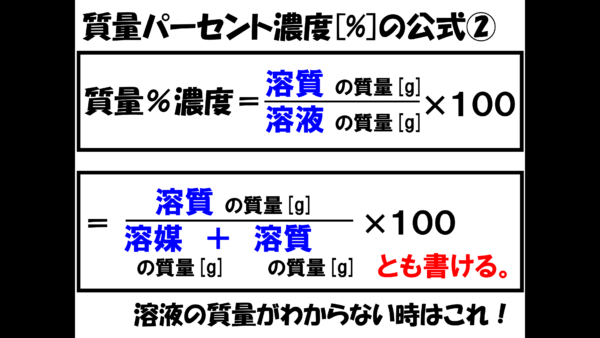
では、溶質の質量を求めたいとき。君ならどうする??
私ならこうする。まぁ、みたまえ。
今、質量パーセント濃度の公式がある。この式の両辺に、溶液の質量をかけてから100を割ってみたい。
するとどうなる??

左辺は、「質量パーセント濃度」×「溶液の質量」÷100。それが右辺の「溶質の質量」とイコールで結ばれるから、この式を利用すれば、溶質の質量が求められるようになる。100で割る代わりに100分の1を書けるとして分数で表現してみるのもいい。
それでは、計算練習してみよう。
例題の③番。20%食塩水が400gある。食塩は何g溶けているか?
質量パーセント濃度は20だ。そこに食塩水の質量400gをかけて100で割ったら答えは、80gとなる。

私からの説明は今日はここまでとしよう。それでは、皆の検討を祈る。
■その他の講義はこちらのガイドを活用ください↓















