それでは、今日の講義を始めよう。
この茶わんに1杯のご飯を盛る。この時、ご飯が150gあったとすると、茶わんの中に米粒は何個あるだろうか?

こんな質問をされた時、みんなはどうする?実際に米粒を1粒1粒数えてみるかい?骨の折れる作業だが、最後の1粒まで数えたら、きちんと答えは出る。
しかし、もう少し楽な方法がある。米粒の質量が全て同じであると考えて、米1粒の質量を図ってみる。すると0.05gだった。であるとするならば、0.05gの米粒が集まって、150gのご飯があると考えると、米粒の数をxとすると、0.05×x=150という式が成立する。

したがって、xは150÷0.05で計算出来て、米粒の数は3000個であると結論出来る。
これを踏まえて今日の本題だ。
ここに質量数12の炭素原子が12gあったとすると、炭素原子は何個存在するだろうか??

先ほどの米粒3000個であれば、たとえ面倒くさかったとしても、直接、お米を手にとって数えることは出来る。しかし、今回の炭素原子は、あまりにも小さすぎて、手にとることは出来ないし、仮に超高性能の顕微鏡で確認できたとしても、1つ2つとカウントしていたら、君たちの寿命がいくつあっても足りなくなってしまう。
ということで、炭素原子の1個の質量を図って、それが集まった結果12gになったと考えていこう。
質量数12の炭素原子の質量は、1.9926×10-23gだから、炭素原子の数をxとすると、
1.9926×10-23×x=12 という式になって、x=6.02×1023となる。

このように計算すると、実際に存在する炭素原子の数を求めることが出来る。
ということで、今回のポイントを確認しよう。
求めることと同じである。
2.1モル12gの炭素(質量数12)には、炭素原子が 6.02×1023個ある。
3.原子量、分子量、式量に[g]単位をつけると、1molあたりの質量になる。
この3つのポイントについて順番に説明していこう。
目次
ポイント1:1モルの炭素原子の数を求めることは、茶わん1杯に盛られたご飯の米粒を求めることと同じである。
これは、さっき確認した通りだな。
ご飯を1回盛ると、150gだ。米粒1コは0.05gだから、お米の数は3000個。2回盛って2杯のご飯になれば、お米の数は2倍の6000個だ。
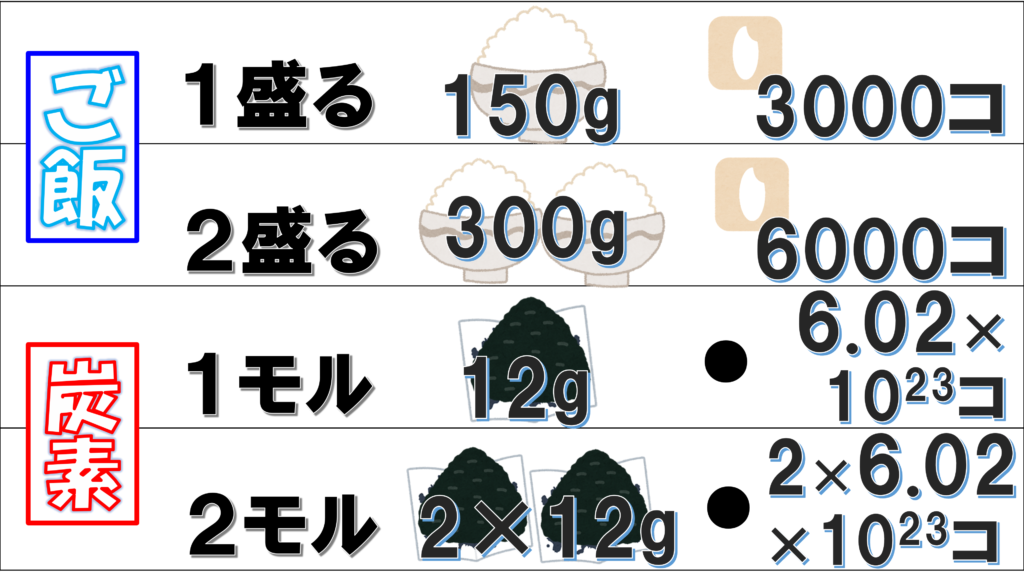
炭素原子は1回盛ると、12g。原子1個は1.9926×10-23gで、原子の数は6.02×1023個。2回盛ると、6.02×1023×2個だ。
■ポイント2.1molの炭素原子について
今、確認したこの関係。大切だから整理しておこう。質量数12の炭素12gに存在する炭素原子6.02×1023個という数。この数は、とても大切だから名前が付けられていて、アボガドロ数という。
そして、6.02×1023個を1つのまとまりとした単位をmol(モル)といい、単位molを使って表した物質の量のことを物質量という。
ご飯の例に当てはめると、
茶わんに1杯盛ったご飯に存在する米粒3000個がアボガドロ定数に相当する。
3000個の米粒の物質量、もしくは茶わん1杯150gのご飯の物質量はいくらかと聞かれたら、1モルと答える。
2杯のご飯なら物質量は2モル。3杯のご飯だったら3モル。4杯なら4モルという。
この関係は、とても大切だからよ~く覚えてもらいたい。
■ポイント3.1molの質量について(モル質量)
さて、ここで確認した炭素原子12gには、更に深い意味が隠されている。12gの12という数字は、炭素原子の質量数の12であり、相対質量の12のことでもある。
相対質量から、原子量を求めるということを前回学習したな。
炭素原子を相対質量の基準として、他の原子の相対質量や原子量については、炭素原子との割合を考えることによって決定するということだった。ということは、1モルの炭素原子が12gであれば、原子量1の水素原子1モルは、1g、原子量16の酸素原子1モルであれば16gと言うように、他の原子や分子1モルの質量は、原子量や分子量、式量にグラム単位をつけた値になる。
つまり、原子量や式量の値にg単位をつけたら、その物質が6.02×1023個 存在することになるのだ。大変便利ではないか?酸素原子は1個、2.656×10-23[g]だから、これに6.02×1023個を掛けると・・・
なんて、面倒くさい計算はやらなくていい。他の物質1モルの質量については、すでに知っている原子量や分子量、式量にグラム単位をつけたらいいだけだ。
この物質1mol あたりの質量のことをモル質量という。
整理すると、

単位ジースラッシュモルで表現して、これをグラム毎モルとかグラムパーモルと読む。
つまり、モル質量は物質の質量を物質量で割ることによって求まる1モルあたりの質量であるということだ。
それでは、今から例題を解いてみよう。

1molとは、6.02×1023個のことなので、この消しゴムの数は、2×6.02×1023=12.04×1023個となる。1.204×1024個としても正解だ。

1molとは、6.02×1023個のことだから、6.02×1023分の3.01 × 1023で約分をすると2分の1となり、小数だと0.5molになる。
それでは、最後の問題だ。

水酸化ナトリウムNaOHの式量は、 23 + 16 + 1 = 40 なので、水酸化ナトリウムのモル質量は、40[g/mol]となる。
さて、今日の講義はここまでとしておこう。それでは、次回の授業でまた会おう。
今回の学習は、ここまでです。
◎異なる単元の学習は、こちらのガイドを活用ください。

![【第2話】おっさん一軒家を買う! [2023年4月〜5月の記録]](https://fzfactory.work/wp-content/uploads/2025/09/第2話:サムネイル-600x338.jpg)
![【第1話】 おっさん鶏を飼う! [2022年4月〜2023年4月の記録]](https://fzfactory.work/wp-content/uploads/2025/09/第1話サムネイル改訂-600x334.png)