
動画による解説はこちら(↓↓↓)を参照ください。
■ポイント1:イオン結合
さぁ、それでは今回はイオン結合ということで話を進めて行こう。まずこちらを見てもらいたい。

この結晶、何から出来ているか知っているかね。初めて見る結晶かもしれないが、皆も一度はお世話になったものから出来ている。それがこれだ。
岩塩。NaCl。
塩化ナトリウムだから、食塩だ。この前、ポップコーンを作ってパラパラ―っと振りかけたではないか。あの粉をまとめて結晶にしてしまえば、このような形になるんだ。ちょっとピンクっぽいがこんな岩塩も存在する。
このNaClについては、前回こんなことを学習したなぁー。それがこれだ。
NaClはNa+とCl-というイオンに分かれるんだったなぁ。
つまり逆をたどれば、この結晶はイオンから出来ているとも考えられる。
今回はこのイオンからなっている固体は一体どのような性質を持っているのか?
ということをこれから見ていこう。
□イオン結合とは
さぁ、
ではイオン結合とは?
ということで、まず、
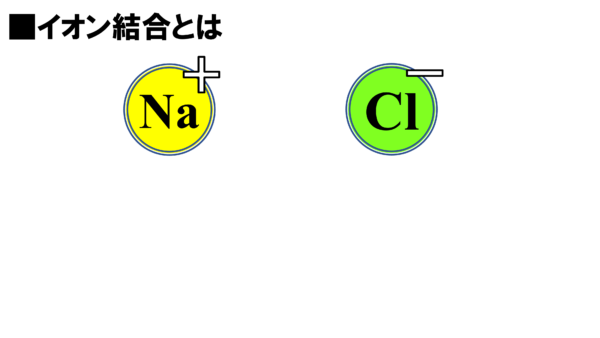
こちら(左)は先ほどあったナトリウムイオンだ。そしてこちら(右)は塩化物イオンだ。陽イオンと陰イオン、つまりプラスとマイナスである訳だが、プラスとマイナスがあったらなんか引き合う気がしないかね。
そうなんだ。この2つが引き合う時に、実はこんな力が働いている。
静電気的な引力、これにはクーロン力という言葉がある。
このクーロン力、しっかりと覚えておくのだ。
このクーロン力が働くと、こうなるのだ。
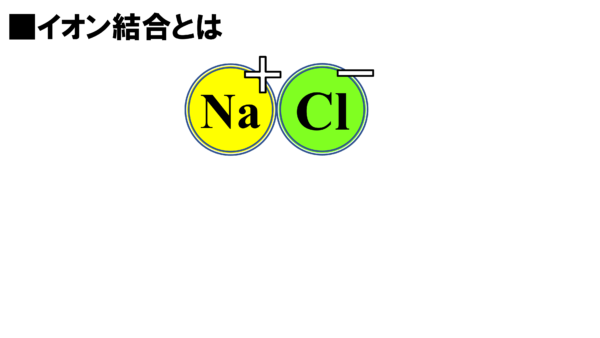
プラスとマイナスのドッキングだ。これがそうなんだ。先ほど皆が見た食塩の結晶になるのだ。こうしてイオンの固体は出来ている。それではここでまとめておこう。
この結合をイオン結合と言う。意味はこうだ。
ここのところをしっかりと押さえてほしい。
それではイオン結晶について見ていこう。
まずはこちらだ。さっき確認した陽イオンと陰イオンがクーロン力でくっついている。これがイオン結合だったなぁ。このイオン結合でくっついた結晶は、立体的に見ると、こんな風になっている。
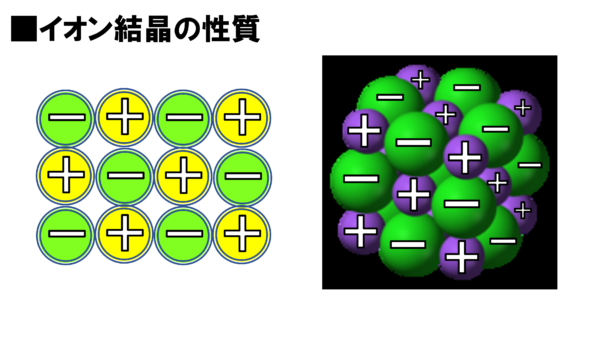
どうだね?規則正しく並んでいるだろう。緑、紫、緑みたいな感じでな。
こうやって規則正しく並んだものを結晶という訳だが、今回はイオン結合でくっついて結晶になっているから、こういうのをイオン結晶と言う。
□イオン結晶の性質
さて、ここからは、イオン結晶の性質、特徴をいくつか見ていこうではないか。

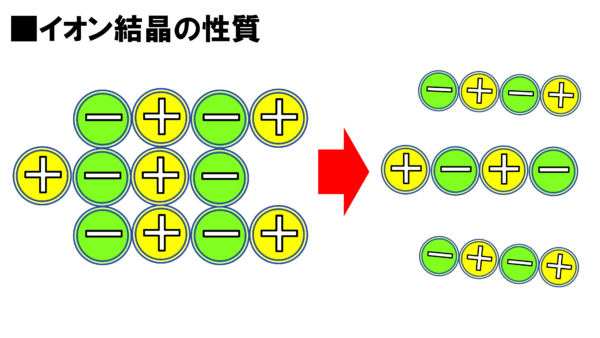
まずは…、この岩塩を叩いて砕いてしまえば、皆が目にする塩になる訳だが、どうやって砕けるか見て見たくはないかね。こちらを見てほしい。

これはNaCl、塩化ナトリウムの結晶だと思ってほしい。
これに力を加えたら、こんな感じになってずれるのだ。
さぁ、ここで問題だ。さっきまでプラスマイナスプラスマイナスとくっついていた。これだからくっついていたが、ずれてしまった。ずれてしまったら、マイナスマイナス、プラスプラス、やばいではないか。反発してしまう。だから、スパーンと切れてしまう。見て見たまえ、こんな感じでスパーンと割れてしまったではないか。
その他に、これは以前確認したことだが、
のも、イオン結晶の大切な性質だ。
後は、
と言ったところを押さえてくれたら今はそれで十分だ。
■ポイント2:陽イオンの形成
それでは、今から原子が陽イオンや陰イオンに変化する様子を確認していこう。
こちらにナトリウム原子がある。一番外のM殻に1個の電子がある。これがイオンになるとどんな姿になるのか?気になるところだ。それがこちらだ。何が違うかわかるかね。この黄色の球、ナトリウム原子の一番外にあった電子がポコーンと飛び出して別れてしまったのだ。
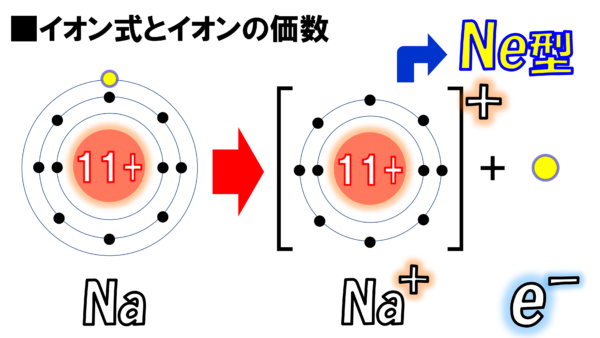
さぁ、そこで残った彼だが、右上になぜかプラスと書いてある。これは元々持っていた電子を失ってしまったわけだ。マイナスを1個失ってしまった。だから、残った彼はプラス1。そして、この人(黄色い〇)は飛び出した電子だ。
さて、ところでだ。この図を毎回書いているととても辛い。そこで、次のような表記がある。Na+と書く。ナトリウム原子から電子が一個なくなった。その分をプラスで表しましたということで、ナトリウムイオンをNa+と表現する。
それから、飛んで行った電子事を忘れてはいけない。かと言って、一個だけ〇と書いてこれが電子だと言っても伝わらない。そこで、電子のエレクトロンの頭文字のeをとってe-と表記する。マイナスの符号も忘れてはいけない。
ところで、ここ(ナトリウムイオン)からもっと電子は飛ぶんじゃないか?と思った諸君。いいところに目をつけた。ここに飛び出せそうな電子がまだまだある。
ところがだ。イオンにはあるルールがある。
そのようなルールに支配されている。
ナトリウムに一番近い希ガスは、水平リーベ、僕の船、ななまがり・・・というのがあったなぁ。ナトリウムの近くの希ガスは・・・、そうだ。ネオンなのだ。よーく見てほしい。K殻電子2個、L殻1,2,3,4,5,6,7,8個。ドンピシャだ。
そうナトリウムイオンはネオン型の電子配置をとる。このことをしっかりと頭に焼き付けてほしい。
■陰イオンの形成
それでは次に進もう。次はこれだ。これは塩素原子だ。この塩素原子を見てもらいたい。ここにある電子がヒョコっと入ったらスッキリするとは思わないかね。そうするとこうなる。
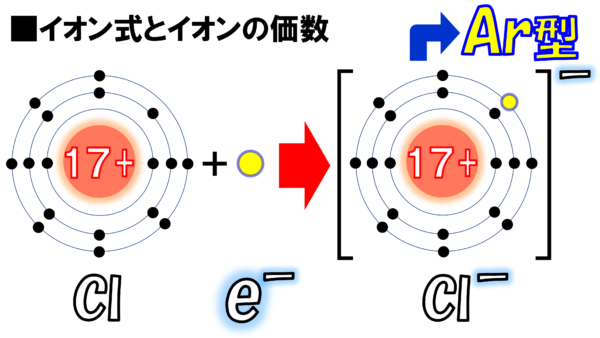
ほーら。スッキリ整理されたではないか。ちなみに見てほしい。M殻に1、2、3,4,5、6,7、8。
ここにアルゴンと同じ電子配置のイオンが完成した。
さぁ、さっきと同じように、この図を何度も書くのは面倒だ。だから、こうやって表現する。Cl-だ。見て見たまえ。Cl原子が電子を1個もらった。-が1個増えたということで、Cl-、そして、ここ(電子配置図の右上)にもマイナスと書いてある。さっきと同じように電子はe―と書いてある。
さぁ、ここで少しまとめておきたいことがある。
まず、
イオンを表す式(Na+やCl-)。これをイオン式と言う。
そしてもう一つ、
今回の場合だったら電子を1個もらっているなぁ。入ってきた電子の数が1個だからこのイオンの価数は1となる。
さて、今日の講義はここまでにしよう。皆の健闘を祈る!
■その他の講義はこちらのガイドを活用ください↓
■資料の閲覧とダウンロードはこちら↓↓↓















