はじめに
さぁ、今回は電子殻と電子配置について話を進めて行こう。
資料のダウンロードはこちらになります。
資料の解答はこちらです。画面をタップもしくは、マウスでクリックすると解答が表示されます。
動画での解説はこちらを確認ください。(↓↓↓)
前回の講義で原子の構造について話を進めてきた訳だが、その時には主に原子核に存在する陽子や中性子について重点的に説明してきた。そこでは、原子の質量は陽子の数と中性子の数でほぼ決まるなんて話をして、電子はいやよ~ なんて語呂合わせも紹介したものだから、電子の存在をつい蔑ろにしてしまった。
しかし、実は、この電子の存在こそが化学反応を決定する重要な要素なのだ。そこで、今回からは電子に焦点を当てて説明を進めることにする。
この前の講義で原子核の存在をラザフォードが発見したという話をしたと思うが、その原子核の周囲に存在する電子の様子を理論的に説明したのが、ニールス・ボーアだ。

さぁ、こちらを見てもらいたい。ヘリウム原子とリチウム原子のモデルだ。
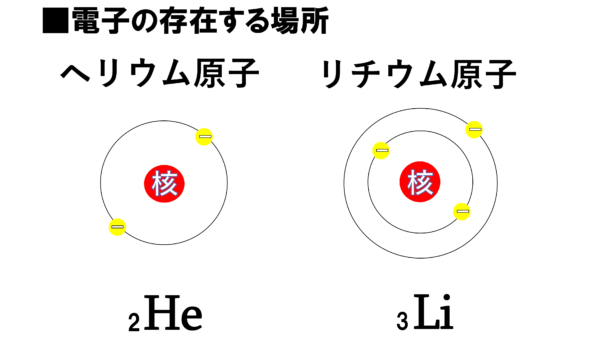
中心の赤い球は原子核を表している。まずヘリウム原子から見ていくが、ヘリウム原子は原子番号2番。陽子の数は2個だから、電子の数も2個だ。そして、あたかもグラウンドに引かれた白線のトラックをグルグル周回するように、原子核の周りを2個の電子が走り回っている。それに対してリチウム原子だ。リチウム原子は原子番号3番だから3つの電子が存在するわけだが、この3つの電子が仲良く同じトラックの上を追いかけっこするのではなく、電子が1つだけ仲間外れにされたかのように1人で外側のトラックを走っている。なぜだ。
実はこの謎を解き明かしたのがニールス・ボーアなのだ。さて、それでは今からこの謎に迫っていこう。
■ポイント1:電子殻
それでは、まず電子殻について話を進めて行こう。こちらが先ほどの原子のモデルになる。
リチウム原子では、ここのトラックを2つの電子が走り回っていて、一つ外側のトラックを仲間外れの電子が寂しく走っていたわけだなぁ。これを立体的に表してみると、こんな風になっている。まるで殻のようなものが何層にも重なっているようだ。そこで、これらは電子殻と名付けたれている。
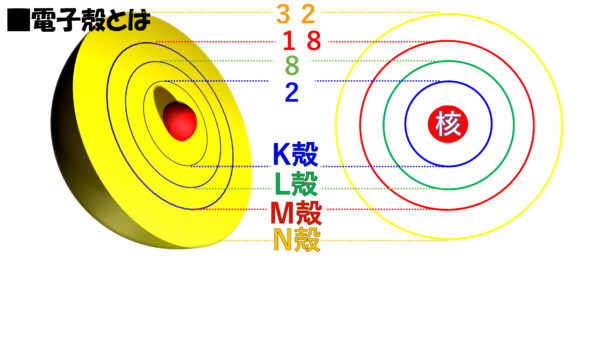
それでは今から電子殻に秘められた謎を解き明かしていこう。まずはこちらからだ。ここ(=中心)には電子はいない。何故なら、ここは原子の中心部分、原子核だからだ。そして、その隣の1周目のトラック。これには名前がついている。ここをK殻という。このK殻という部分には2まで電子が入れるのだ。続いて、一番内側から数えて、2番目のトラックをL殻という。このL殻には8個まで電子が入ってOKなのだ。さらに内側から数えて、1、2、3周目をM殻という。M殻には18個まで電子が入れるのだ。そして、さらに内側から数えて4周目のトラックをN殻という。N殻には32個入れる。今紹介した電子殻は、内側からアルファベット順に並んでいるから、覚えづらくないと思う。
ここで整理をしておくと、中心の原子核の外側には電子殻という殻があるんだなぁ。そして、この電子殻にはK殻、L殻、M殻、N殻・・・というのがあって、そこに納まる電子の個数にはルールがあるという訳だ。しっかりとこの図を頭に焼き付けてもらいたい。
そして、このルールに従って電子を決まった場所に配置させることを電子配置というのだ。
■ポイント2:電子配置図について
それでは電子が納まるルールに従って電子配置図を描いてみようではないか。
今から酸素原子を例に解説していくからよ~く注意して聞いてくれ。
まず中心に原子核を表す円を書き、その周りに電子殻を書く。
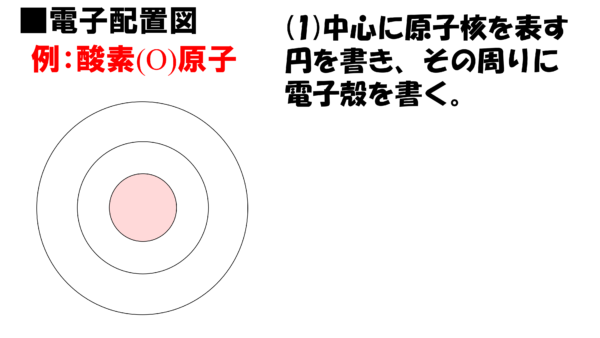
原子核に存在する電荷を中心の円柱に書く。酸素原子は原子番号が8番だから陽子の数は8個。だから中心の円の中には8プラスと書く。ここではプラス8と書くのではなく、「+」の記号を8の右側に書くことになっているから注意してほしい。
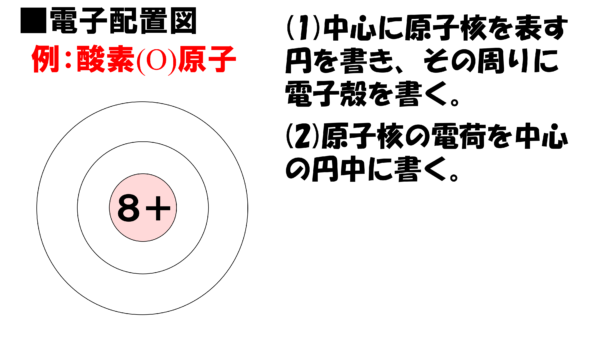
そして、電子殻上に原子核に存在する陽子の数だけ電子を書き入れていく。この時、K殻から順番に電子を書き入れていく。K殻に入る電子の数は2個までだから、3個目の電子からはL殻に書き込むことにも注意するのだぞ。
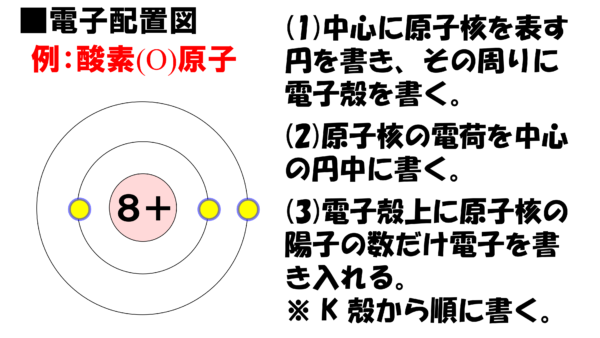
したがって、酸素原子であれば、K殻に電子を2個、L殻に電子を6個書き込むことになる。ちなみにL殻に電子が8個入ったら、次の電子はM殻に入ることになるのだ。さぁ、これで酸素原子の電子配置図の完成だ。
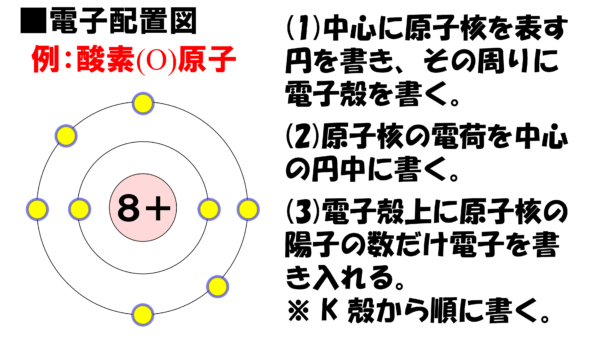
諸君は一度、酸素原子以外の電子配置図を描いて基礎から鍛錬するのだぞ。
ここで覚えておいてもらいたい言葉がある。一番外側の電子殻に入っている電子には最外殻電子という名前が付けられている。この最外殻電子は、化学結合や化学反応において重要な働きをすることになるからしっかりと押さえておいてほしい。そして、化学結合や化学反応に関わる最外殻電子のことを時には価電子と呼ぶことがある。最外殻電子と価電子という言葉、よく注意して覚えてほしい。

■ポイント3:最外殻電子と価電子について
ここで最外殻電子と価電子について、もう少し詳しく見ていこう。
最外殻電子とは、一番外側の電子殻に存在する電子のことで、化学反応に深く関係する電子だ。一方、化学反応に関係する電子のことを価電子という訳だから、最外殻電子と価電子は同じ意味を指す言葉になるのだが、例外が存在するから気を付けてほしい。
今から、貴ガスと呼ばれる原子の電子配置を見てみよう。
ヘリウム、ネオン、アルゴン、クリプトン、キセノン、ラドンの計6元素のグループを貴ガスと呼ぶ。
この原子たちの名称も覚えてもらいたいのだが、覚え方は、
へんな、ねーちゃん、あるいて、くるよ、きせるくわえて、ランランランだ。
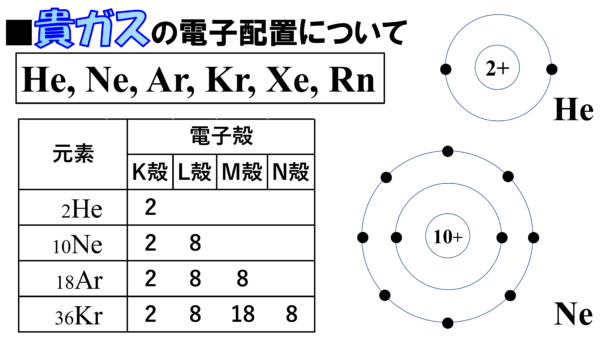
さて、この貴ガスの原子の内、ヘリウムとネオンの電子配置図を見てもらいたい。
ヘリウム原子はK殻に2個、ネオン原子にはK殻に2個、L殻に8個の電子が入っていて、どの電子殻にも目一杯電子が入っていて満員状態になっているだろ。このように、最外殻電子が満員の状態のことを閉殻という。
実は、最外殻電子が閉殻状態の時は、原子はとても安定な状態で存在できることが分かっている。とても安定な状態で存在しているから、絶えず変化することがない。これは言い換えると、他の原子との化学反応が起こりにくいということだ。同じように、最外殻電子が8個存在するアルゴン原子やクリプトン原子も、安定な原子であることが分かっている。
さて、ここで本題に入るが、こちらの表にヘリウム原子、ネオン原子、アルゴン原子、クリプトン原子の電子配置がまとめてある。最外殻電子の数は、順番にヘリウムが2個、ネオンが8個、アルゴンが8個、クリプトンが8個となる訳だが、価電子の数はどうなるのかというと、価電子とは化学反応に関係する電子のことだったなぁ。そして、今、ここに示す貴ガス原子は、化学反応が起こりにくい、単独でとても安定な原子であり、化学反応に関係する電子は存在しない。
だから、「貴ガス原子の価電子の数は、0 個」と考えるのだ。
ここのところはよ~く注意してもらいたい。いいかね。価電子とは、化学反応に関係する電子のことだ。貴ガスはとても安定な原子集団だ。だから化学反応を起こす電子は存在しない。だから貴ガスの価電子数は0と考えるのだ。
それでは、ここで例題を1つやっておこう。
次の元素の最外殻電子数、価電子数を答えよ。

1つ目の酸素だが、最外殻電子の数は、先ほど確認した通り、6個で、価電子の数も6個だ。次のヘリウム原子の最外殻電子の数は、2個。そして、価電子の数は、ここでヘリウム原子が貴ガスと呼ばれる原子であることに注意すると0となる。同じく、貴ガス原子のネオン原子は、最外殻電子は8個で、価電子数は0.最後の塩素原子は、最外殻電子の数は、1,2,3,4,5,6,7個で、価電子の数も同様に7個だ。
さて、今日はここまでにしておこう。今回学習した電子配置については、これからイオンや化学結合について学習する時に大切になってくるからしっかりと押さえてもらいたい。それでは、皆の健闘を祈る。
■その他の講義はこちらのガイドを活用ください↓