それでは今日の講義を始めよう。
今回は、空間に存在する気体の体積と気体の個数の関係に迫っていきたい。
①:気体の体積は、温度や圧力(大気圧)の影響を受ける。
②:0℃1気圧の状態を標準状態として、これを基準とする。
③:モル体積とは、標準状態における1モルの気体の体積であり、
■ポイント1.気体の体積について
それでは、最初に気体の体積について考えてみよう。
ここにヘリウムガスを充てんした風船がある。

これを液体窒素で冷却してみる。すると風船がしぼんでしまう。

そして、冷却を止めると再び風船が元の状態まで膨らんでくる。これは、つまり、
気体の体積は温度によって変化する
という事だ。気体は温度が下がると、体積が減少して、温度が上昇すると体積が増加する訳だなぁ。
それから、冷却して体積が減少すると、風船が浮かばなくなる。

風船を浮かび上がらせる浮力は、気圧の影響、によって発生する力であり、風船の体積が変化すると浮力は変化する。
ちなみに気圧とは、空気による圧力のことであり、天気予報を見ていると出てくる。ヘクトパスカルで表現される量のことだ。高気圧とは空気の量が多い状態で、空気が密集しているから圧力は強く、逆に低気圧とは空気の量が少ない状態で、空気がスカスカだから圧力は弱い。
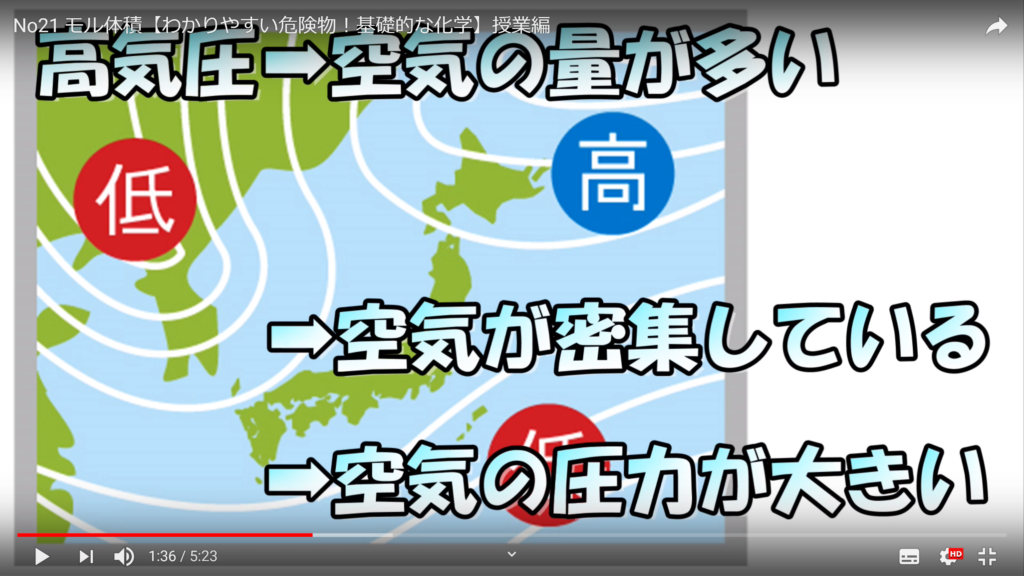
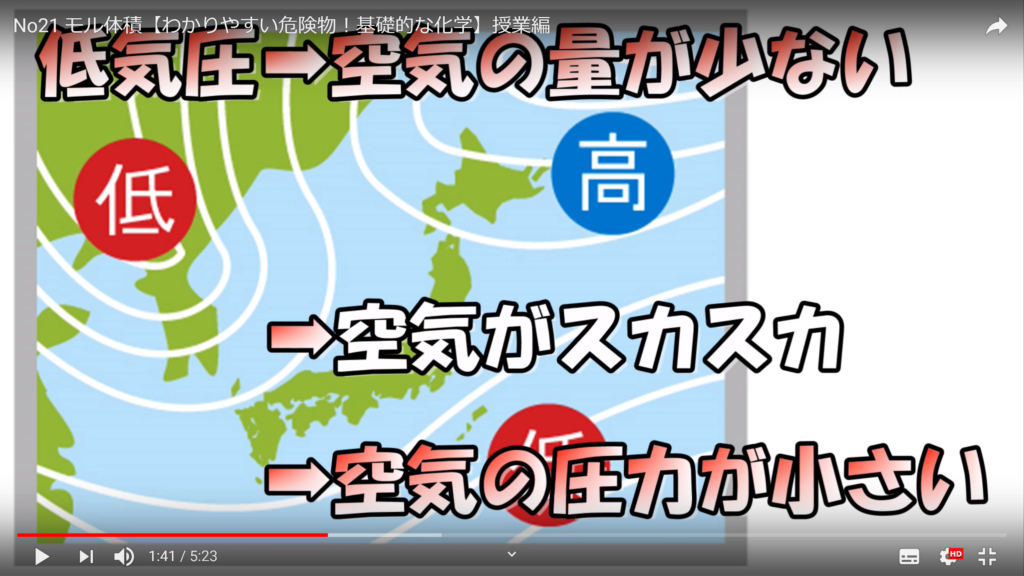
空気は高気圧のところから低気圧のところに向かって流れる。これが空気の流れを起こし、気候の変化を発生させるのだ。1気圧とは1013hPaに相当して、台風が発生すると、900hPaまで気圧が下がる。

話を戻して、ここで、皆に知ってもらいたいことは、
気体の体積は、温度や圧力の影響を受ける
ということだ。
だから、これから気体の体積を正確に考える時は、温度や圧力の条件を一定にしないといけない。
■ポイント2.標準状態
今、気体の体積と温度や圧力の関わりについて説明したが、ここにはとても重要な法則がある。
「すべての気体は同温・同圧のとき、同体積中に同数の分子を含んでいる。」
これをアボガドロの法則という。

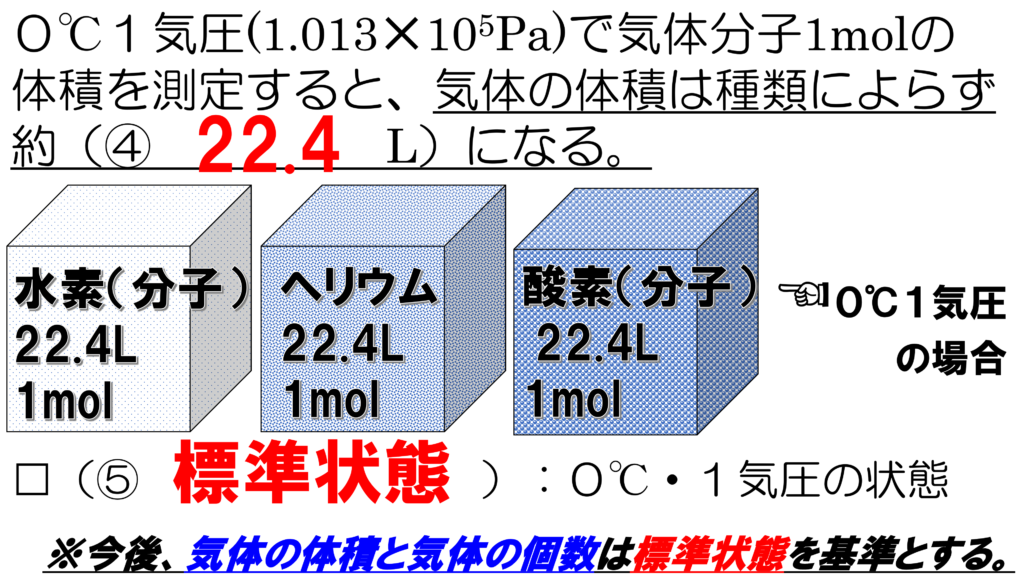
例えば、0℃1気圧の気体分子1モルの体積を測定すると、気体の体積は種類によらず、約22.4Lになる。
逆に、0℃1気圧で、気体分子の体積が22.4Lであれば、そこには1モルの気体分子が存在する。
ヘリウムであろうと、水素分子であろうと、酸素分子であろうと、0℃で1気圧の22.4Lの体積中には、1モル、つまり6.02×1023個の気体分子が存在する。
この時、
温度と圧力の基準を0℃1気圧
としたが、これを標準状態という。
今後、気体の体積と個数の関係を考える時は、標準状態を基準とするから、アボガドロの法則と併せて、しっかりと押さえてもらいたい。
■ポイント3.モル体積
それではモル体積について確認しよう。
モル体積とは文字通り気体1molあたりの体積のことだ。
標準状態では1モルあたり約22.4L であり、22.4L/molという単位で表現する。
モル体積を使って、物質量と気体の体積の関係を表現すると、物質量イコール、22.4分の気体の体積となる。

この関係を使って、気体の体積を元に、その気体の物質量、つまり気体分子の数が求められる訳だ。
それでは実際に例題を解いてみよう。
例題1:2molの水素の体積は、標準状態で何Lか。
さっき確認した通り、標準状態では、1モルの気体の体積は22.4Lだ。今、気体の水素が2mol存在する訳だから、その体積は、22.4L掛ける2で44.8Lとなる。

例題2:0.25molのヘリウムの体積は、標準状態で何Lか。
0.25molとは、分数だと4分の1になるな。つまり、22.4Lの4分の1が今回求めたいヘリウムの体積となる。だから、22.4掛ける4分の1で5.6Lが答えとなる。

今日の講義はここまでとしておこう。それでは次回の講義でまた会おう。
今回の学習は、ここまでです。
◎異なる単元の学習は、こちらのガイドを活用ください。