動画による解説はこちら(↓↓↓)より確認ください。
■ポイント1:電気を通す物質と通さない物質
それでは、今日の講義を始めよう。
さぁ、まずは、電気を通す物質と通さない物質ということで、砂糖水と食塩水を準備した。(食塩水を指して)こちら。ピカピカに光っているなぁ。皆も知っての通り、砂糖水は電気を通さない。それに対して、食塩水。こちらは電気を通す。原料の違いによって、電気を通す方と通さない方に分かれるのだなぁ。これには名前がついていた。それがこちらだ。

砂糖の方を非電解質。食塩の方を電解質と言ったのを諸君は覚えているかな?
ところで、電解質水溶液の方で、何で電気が流れたのか、気にならないかね。きっとこの中で、電気を通す仕組みが出来上がっているはずだ。そこのところを、今から化学的な目線で探っていこう。
□イオンと電解質
今からイオンと電解質ということで話を進めて行こう。
ここに、NaCl、食塩と言う電解質がある。
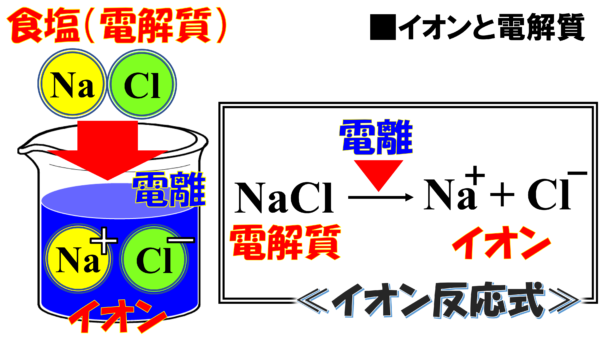
これを水に放り込むとNaの+の球とClの-の球に分かれる。このことを電離というのだ。電気的に離れるというイメージで理解すればいいのだ。さらに、NaClが電離した、この球のことをこのように言う。イオン というのだ。中学校でも聞いたことがあるだろう。これのおかげで電気が通るようになるのだ。砂糖水では、このようなことは起こらない。食塩だったら、プラスとマイナスに分かれるから電気が流れるイメージだ。
ところで、これからしばらくイオンについて学習することになるが、毎回毎回このような図を書いて説明するのも手間がかかるだろう。そこで、これを次のような書き方をする。
NaCl 電解質である食塩が電離したら、イオン。つまり、Na+とCl-に分かれると、このような式の形で一発で表現できるのだ。まずはこのような反応式による書き方があるということを知っておいてもらいたい。ちなみにこの反応式のことをイオン反応式という。
■ポイント2:陽イオンと陰イオン
次に陽イオンと陰イオンについて説明していこう。さて、先ほどのNaCl。これは電解質だから水の中に放り込むとこんな形で電離するのだったなぁ。そうNa+の球とCl-の球だ。さぁ、この2つの球をイオンと呼ぶわけだが、それぞれの固有の名前は、こうなっている。こちらのプラスの方をナトリウムイオンという。それに対してマイナスの方を塩化物イオンという。
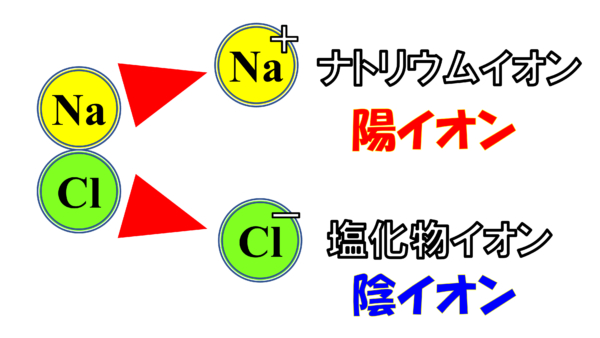
名前くらいは聞いたことがあるかもしれない。さぁ、今プラスとマイナスに分かれた訳だ。正式な言葉でいうと正電荷をもつものと負電荷をもつものということになる。このプラスに偏ったやつのことを実はこのように言う。陽イオンというのだ。正電荷を持つイオンのことだ。それに対して、塩化物イオンのことは 陰イオンと名付けられるのだ。負電荷を持つものだ。
簡単だろう。正の方が、陽イオン。マイナスの方が、陰イオンということだ。
■金属元素と非金属元素
少し話は変わって、今から一度周期表に戻って金属元素と非金属元素の話をしておこう。イオンの話をしているのに突然周期表が出てきて、これから金属の話をするっているから、動揺してしまったかね??大丈夫だ。心配はいらない。後で、きちんとイオンの話に戻るから落ち着いて聞いてほしい。
まずは金属元素からだ。金属というと、共通する主な特徴を確認しておくと次のようになる。金属特有の光沢。金の延べ棒などキラキラ輝いているなぁ。そして、電気伝導性。金属は電気をよく通す。それから、最後に熱伝導性だ。金属は熱をよく伝えるから、鍋やフライパンには金属が使われているのだなぁ。

このような特徴を持った金属元素は、この周期表のどこに隠れているのか。それがこちらだ!!
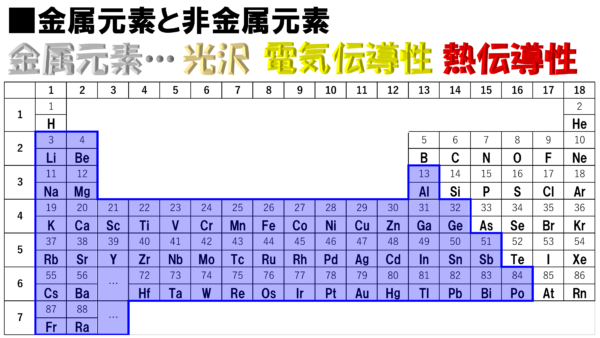
おぁ、隠れるどころか金属ばかりではないか。しかも案外まとまって分布している。右端のところがギザギザしているが、この金属元素ではない右上を基準にして考えると、金属元素は、まぁ左下に集まっているという感じだな。
さぁ、それから非金属元素だが、金属元素に非ずという訳だから、ここの赤色で示された部分を指すのだ。
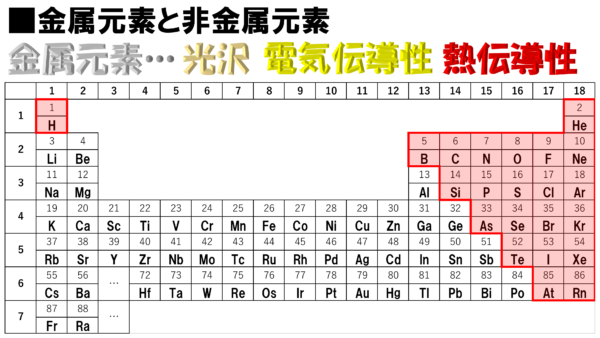
全体的に右上に集合して整列している感じだな。ちょっと、この子だけ、空気が読めていないというか、集団から離れたところにいるが、全体としてはまとまっている。そのように考えてみると、周期表はよく整理されていると思わないかね。
□陽性元素と陰性元素
さて、今の話を踏まえて、陽性と陰性ということについて皆に伝えておきたい。
陽性とは、価電子を失って、陽イオンになり易い性質のことだ。これはどういうことかと言うと、電子はマイナスの電気を持っているのだったなぁ。それを失ってしまったら、プラスになるではないか。言うなれば、陽性とは陽気な性質。マイナス思考を取り除いて、明るく陽気にポジティブになっていこうってなイメージだな。
この陽性を持つ元素、陽性元素が周期表のどのあたりにいるかと言うと、大体この辺り。周期表の左下に陽性の大きな元素が存在するのだ。だから、周期表の左下のこの辺りの元素は、価電子を失って、陽イオンになり易いと覚えておくのだ。
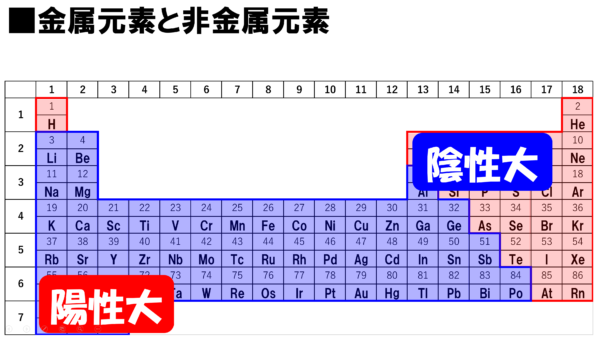
それでは続いて、陰性だが、これは、電子を取り込んで、陰イオンになり易い性質のことだ。これは、電子を取り込むということは、マイナスの電気を余分に持つことになるなぁ。それで陰イオンになると言っているわけだ。
マイナス思考をため込んだ暗くてネガティブな陰キャラになってしまうってわけかぁ。
この陰性を持つ元素が、周期表のどのあたりにいるのかと言うと、陽性が左下だったから、陰性は・・・、察しの通り、この辺(右上)だ。覚えやすいだろう。陽性が左下と覚えておけば、陰性は逆向きの右上だとわかるわけだ。ただし、注意が必要だ。18族元素、貴ガスは陰性元素ではない。貴ガスは価電子の数は0。化学的性質が変化する電子が存在しないから、陽イオンにも陰イオンにもなりにくい。貴ガス元素は、陽キャラでも陰キャラでもないノーマルキャラクターだ。
さぁ、金属元素と非金属元素と併せてまとめてみよう。
非金属元素は周期表の右上に密集していて、右上に行くほど陰性が強い。
おぁ~、そうか~。金属元素は陽イオンになり易くて、非金属元素は陰イオンになり易いということが見えてきたではないか。塩化ナトリウムは、確かに金属元素のナトリウムと非金属元素の塩素が結合していて、水の中で電離すると陽イオンのナトリウムイオンと陰イオンの塩化物イオンに分かれているではないか。
金属元素と非金属元素、そして陽性と陰性。これは大切な規則性だから、この図をきちんと頭に焼き付けて理解してもらいたい。
さて、今日の講義はこれくらいにしておこう。皆の健闘を祈る。
■その他の講義はこちらのガイドを活用ください↓