
はじめに
今回は原子の構造について話をしよう。
(動画による解説はこちらよりご覧ください。↓↓↓)
■ポイント1:原子の構造について
原子とは、それ以上分割出来ない基本的な粒子であると以前伝えたのは覚えているかな。しかし、原子はさらに細かく分割されることが判明し、今から100年ほど前にラザフォードらの功績によって、原子はこれから説明するような構造を持つということが分かって来たんだ。それでは、順番に説明していこう。
まずは、こちらの図を見てもらいたい。
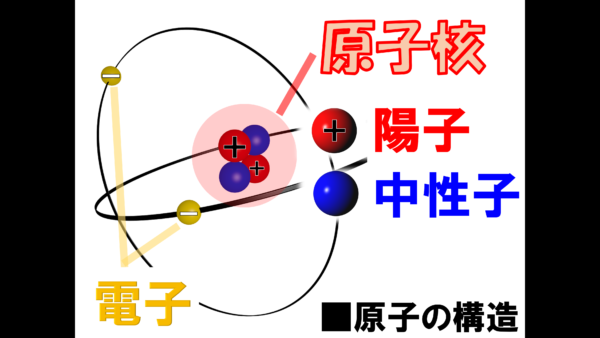
これはヘリウム原子の構造を示した模式図だ。実は、原子は原子核と言われる部分と電子に大きく分けることが出来るのだ。この原子核の存在を発見したのがラザフォードなのだ。
さらに原子核と呼ばれる部分には、プラスと書かれた赤い球の陽子と何も書かれていない青い球の中性子に分けられるんだ。
■ポイント2:陽子、中性子、電子の性質
今から、陽子、中性子、電子の性質を見ていこう。
先ほどは、原子の構造について説明をした。この時に気になることはなかったかね。
例えば、陽子にはなぜかプラスと書いてあって、電子にはマイナスと書いてある。それでいて、中性子には何も書かれていないであろう。
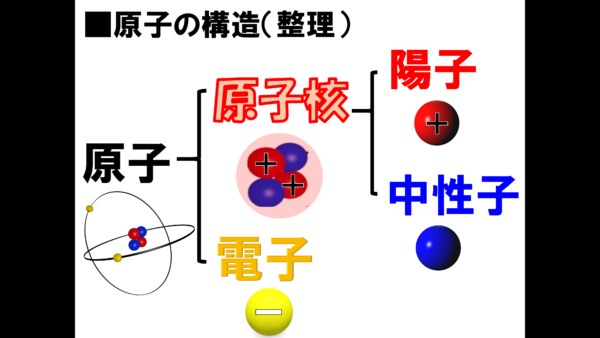
そうなんだ、この3つの粒子は、全然性質が違うのだ。このことについて今から説明しよう。
まず、陽子や電子にプラスとかマイナスと書かれているから、諸君には電荷というものをイメージしてもらいたい。
電荷とは、電気の電に荷物の荷という文字からその意味を解釈すると、電気的な何か荷物を持っている様子がイメージ出来ないかね。そうなんだ。
そして、陽子は図の通り、プラスの電気を1つ持っているのだ。それに対して、電子は、察しの通りマイナスの電気を1つ持っている。では、中性子はどうだろうか。中性と書いているくらいだから、そう、プラスマイナス0の中間、つまり電荷は0になるのだ。
ちなみに、もう一度ヘリウム原子を見てみると、中心の原子核に陽子と中性子がある。陽子が2つあるから中心はプラス2の電荷がある。一方、外側を見ると電子が2つだからマイナス2の電荷がある。中心だけを見ればプラス2、外側だけを見ればマイナス2だが、全体を見れば、プラス2とマイナス2だから、プラスマイナス0の状態なのだ。
この言い回しにも慣れておいてもらいたい。
それからもう一つ知っておいてもらいたい事がある。
それが3つの粒子の重さについてだ。と言っても、それぞれの粒子の質量がいくつなのかを正確に知る必要はない。とりあえずとてつもなく軽いという程度にことだけ覚えることにして、ここで強調しておきたいのは、それぞれの粒子の質量の割合、つまり質量比についてだ。
まず陽子を基準として考えると、陽子を1とすると中性子は1だ。それから、電子はいくつになるのかと言うと、ここがポイントになるのだが、
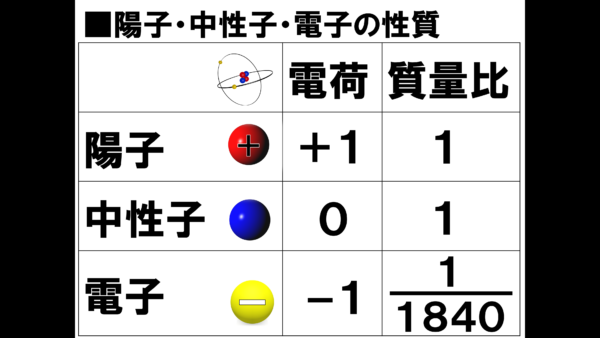
これは例えば、体重60kgの人が陽子だとすると、電子の質量は、たったの0.03kgということになる。この軽さだと身体測定の時には、誤差として記録に残ることはないであろう。
つまり、電子の質量は、陽子や中性子に比べると無視できるほど小さいということだ。これは後々大切になってくる情報だから、きちんと押さえておいてほしい。ちなみに1840分の1という数字の覚え方は、
■ポイント2:原子番号と質量数について
それでは次のテーマに行こう。
今、ここにプロ野球選手が立っている。

しかし、このプロ野球選手が誰なのかは、わからないだろう。しかし、こうして背番号が表示されていたらどうだろうか。

野球好きの人なら、この時に思い思いのプロ野球選手を思い描くことだろう。私だったら51番と言えば、イチロー選手をイメージする。こうして背番号が与えられていると、顔を確認しなくてもそれが誰なのかが確認できる。
さて、ここで本題に移るが、実は原子にもあるルールに従って背番号が与えられている。背中に与えられる番号だから背番号、そして、原子に与えられる番号だから、これを原子番号と言う。単純だろ。
では実際にヘリウム原子で見ていこう。
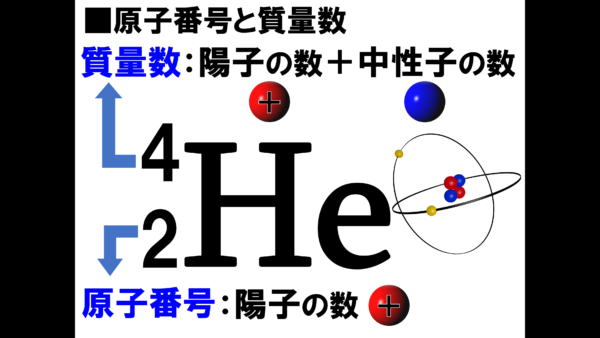
ヘリウム原子の構造を表した右の図に対して、左の図の元素記号の左上に4左下に2と書かれたものもヘリウムの構造を表現したものである。それでは、この4と2という数字について説明していこう。
まず左下の2という数字は、原子番号を表している。これがヘリウム原子に与えられている背番号のようなものだ。そして、この背番号は、陽子の数によって決められている。そこで、ヘリウム原子にある陽子の数を数えてみると、2個だ。プラスの球が2個あるから、ここは2となっているのだ。
次に左上の4に移る。こちらは質量数と呼ばれている。質量数は、陽子の数プラス中性子の数と書かれている。もう一度、ヘリウム原子の図を見ると、おぉ、これは原子核を表しているのか。原子核を見てみると、赤い球の陽子が2個、白い球の中性子が2個あるから、これを足したら合計は4だ。とても単純だろ。陽子の数に中性子の数を足したら質量数になると言っているのだ。
ここでまとめておくと、原子番号とは原子の背番号のようなものだ。そして、原子番号は陽子の数を数えるだけ。プラスの球の数を数えるだけだからすごく簡単だろう。そして、左上の数字、質量数は、陽子の数と中性子の数を足すだけだから、2足す2で合計が4となる。この数字の位置関係をよく覚えてもらいたい。
さて、次にいこう。

またまたこちらのプロ野球選手だ。このプロ野球選手が引退して1年後、激太りしてしまった。引退してしまったら、トレーニングすることが無くなってしまうから、美味しいものばかり食べてしまうとブクブクと太ってしまう。なんてことがあるだろう。実は化学の世界でも同じことあるんだ。同一人物だけど、体重が異なるように、同じ原子であっても質量が異なる原子が存在することがあるんだ。このような原子の関係のことを同位体というんだ。
それでは実際に見ていこう。
今、ここに3つの原子のモデルがある。
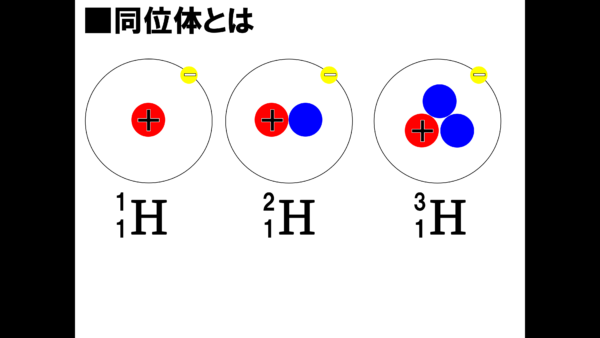
さぁ、ここで間違い探しだ。まず、このプラスの球は陽子だったなぁ。そして黄色い球が電子だ。3つの原子はどれも陽子の数は1個だから原子番号は1番だ。ちなみに、この原子の名前は水素だ。しかし、質量数に目をやると、1、2、3と原子番号は同じなのに質量数が違うではないか。このような関係のことを同位体という。カタカナで言うとアイソトープともいう。まずこの言葉を押さえておいてもらいたい。
それでは、詳しく数字でまとめていこう。
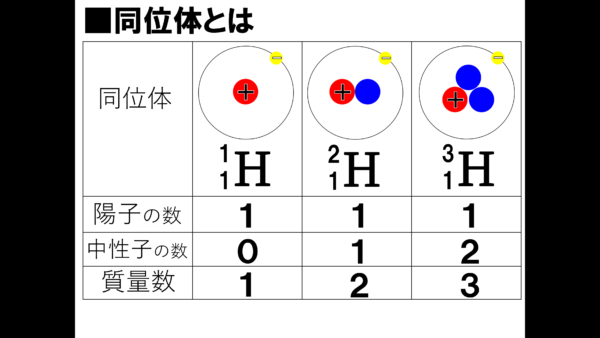
まずは1番左側の水素原子。陽子の数は1個、中性子は存在しないから0だ。そして気になる質量数は、陽子の数と中性子の数を足せばよいわけだから1となる。では、ここからが重要だ。真ん中の水素原子。陽子の数は1個だ。そして、中性子の数は先ほどとは異なり1個くっついて、質量数は1足す1で2となっている。中性子の分だけ重くなる。中性子だけに中性脂肪がくっついて重くなるという感じか。くだらない親父ギャグは置いといて、同じように一番右側の水素原子を見てみよう。陽子の数は変わらず、中性脂肪の数は2個になっている。激太りだ。したがって質量数は3となる。最初の水素原子より3倍も重くなっているではないか。そうなんだ、質量数とは人で言う所の体重のようなものなのだ。
さぁ、ここで同位体についてまとめておこう。
さて、ここで原子の右上にポツンと存在する電子の重さは考えなくていいのか??という疑問が沸き起こる。勘のいい人だったら、もう気付いているだろう。今日の復習だ、陽子と中性子と電子の質量比の関係はどうだったかな。
なになに??もう勉強はいやよ~・・・だって。
おぉ、よく覚えているではないか。電子の質量は陽子や中性子の質量と比べると1840分の1だったんだなぁ。そう、電子の質量は、陽子や中性子の質量に比べると無視できるほどに小さい。だから、原子の重さ、つまり質量数について考える時は、電子の質量は考えなくても差し支えないのだ。
どうだい。わかってくれたかな。それでは、今日の講義はここまでとしよう。皆の健闘を祈る。
■その他の講義はこちらのガイドを活用ください↓















